题目内容
8.二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)、△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如表所示
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的自发性可能自发(填“一定自发”、“可能自发”或“一定不自发”);反应Ⅱ的平衡常数表达式为$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ的△H3和△H1、△H2的关系△H3=2×△H1+△H2反应.
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为5.0MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是43.75%.

(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在上图中画出t4-t6的变化曲线.
分析 (1)分析图表K1>K1′判断反应Ⅰ为放热反应,再根据反应自发进行依据△G=△H-T△S判断;根据化学平衡常数概念写反应Ⅱ的平衡常数表达式;由盖斯定律得反应Ⅲ的△H3和△H1、△H2的关系;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
(3)增大压强,平衡向正反应方向移动,结合图象,判断A、B两条曲线对应的压强,从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,故A曲线对应压强为5.0MPa,曲线对应压强为0.1MPa,从图中可知压强为5.0MPa、温度为200℃时CO的转化率为0.7,然后利用三段式列式计算甲醇物质的量分数.
(4)①该反应是一个反应前后气体体积减小的且正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度,据此画出变化的图象.
解答 解:(1)由图表K1>K1′判断反应Ⅰ为放热反应,△H<0,该反应是个气体体积减小的反应,则△S<0,则
根据△G=△H-T△S,温度较低时△G<0,能自发进行,温度较高时△G>0,反应不能自发进行,所以该反应可能自发;
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g);K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)^{\;}}$;
已知:反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)、△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
根据盖斯定律,Ⅰ×2+Ⅱ=Ⅲ,则,△H3=2×△H1+△H2;
故答案为:可能自发;K=$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$;△H3=2×△H1+△H2;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
故答案为:此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
(3)从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,故A曲线对应压强为5.0MPa,曲线对应压强为0.1MPa,从图中可知压强为0.1MPa、温度为200℃时CO的转化率为0.7,
设加入COamol,则有H22amol
CO(g)+2H2(g)?CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.7a 1.4a 0.7a
平衡时(mol) 0.3a 0.6a 0.7a
平衡混合气中甲醇的物质的量分数是$\frac{0.7a}{0.3a+0.6a+0.7a}×100%$=43.75%;
故答案为:43.75%;
(4)①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度;
故答案为:增大生成物C浓度,升高温度;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度,所以其图象为: ;
;
故答案为: .
.
点评 本题考查了熵变焓变的判断、化学平衡常数表达式的书写、外界条件对反应速率的影响等知识点,看清图象表达的含义是解题的关键所以,图象的理解和绘制是解题难点,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
?CO(g)+2H2(g)?CH3OH(g)?CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
甲醇与CO的结构式分别如图:
(1)已知反应?中相关化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)温度为110℃条件下,向体积2L的密闭容器充2molCO2与4molH2,发生反应?,10min后达到平衡状态后测得甲醇浓度为0.5mol.L-1.求氢气的反应速率:0.15mol/(L•min).
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
通入甲醇的电极是负(填“正”或“负”)极,反应时该电极附近的现象是溶液红色变浅,溶液中K+向正(填“正”或“负”)极移动:写出正极反应式:O2+2H2O+4e-=4OH-;若电池工作过程中通过2mol电子,则理论上消耗O211.2L(标准状况).
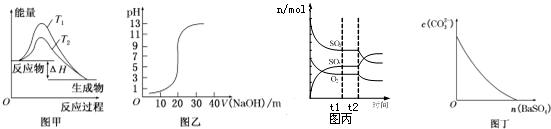
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |
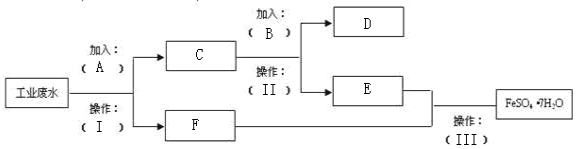
| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
| A. | BaSO4粉末可用作钡餐,是因为BaSO4为非电解质 | |
| B. | 有机物苯、乙醇、蔗糖都属于非电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 固态共价化合物不导电,熔融态的共价化合物都可以导电 |
 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1