题目内容
7.氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.(1)氨催化氧化法是工业制硝酸的主要方法.已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-905.0 kJ/mol.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4 kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是AB(填字母).
A.由图1可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)电化学法是合成氨的一种新方法,其原理如图2所示,通入H2的一极为阳极(填“阴极”或“阳极”),阴极得电极反应式是N2+6H++6e-=2NH3.

(5)氨碳比[$\frac{n(N{H}_{3})}{C{O}_{2}}$]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响,T℃时,在一体积为2L地 恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图3所示,a,b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数,$\frac{n(N{H}_{3})}{C{O}_{2}}$=2时,尿素的产量最大;该条件下反应的平衡常数K=40.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)平衡常数随温度变化,与压强和浓度变化无关,平衡常数变化结合反应一定原理分析判断;
(3)A.由图可知,温度一定时,压强增大氨气的体积分数增大;
B.合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低,氮气的转化率越高;
D.不同物质表示的正逆速率之比等于化学计量数之比,说明可逆反应到达平衡;
设参加反应的氮气为n mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
根据平衡时氨气的体积分数方程式计算n,进而计算氮气的转化率;
(4)通入H2的一极为化合价升高,发生氧化反应,该极为阳极;合成氨的阴极上氮气得到电子生成氨气;
(5)由图可知,横坐标为$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=2时,尿素的体积分数最大,氨气的转化率为80%,以此计算该条件下反应的平衡常数K.
解答 解:(1)已知:
①2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1
②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1
由盖斯定律②×3-①×2得到热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,K1>K2;
故答案为:>;反应是放热反应,温度升高,平衡逆向进行,平衡常数减小;
(3)A.由图可知,温度一定时,压强增大氨气的体积分数增大,故A正确;
B.图B中T=500℃,合成氨是放热反应,压强一定时,降低温度平衡向正反应方向移动,平衡时氨气的体积分数增大,则温度为450℃时对应的曲线是b,故B正确;
C.500℃温度时反应速率加快及催化剂活性最好,正反应为放热反应,温度越低氮气的转化率越高,高温不利于氮气的转化,故C错误;
D.当 3v正(H2)=2v逆(NH3)时,正逆速率不等,不同物质表示的正逆速率之比等于化学计量数之比,应为2v正(H2)=3v逆(NH3),反应到达平衡,故D错误;
故选:AB;
②设参加反应的氮气为n mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):10 40 0
转化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
则$\frac{2n}{10-n+40-3n+2n}$×100%=25%,解得n≈5,所以氮气的转化率为$\frac{5mol}{10mol}$×100%=50%,
故答案为:50%;
(4)通入H2的一极为化合价升高,发生氧化反应,该极为阳极;,合成氨的阴极反应为N2+6H++6e-=2NH3,
故答案为:阳极;N2+6H++6e-=2NH3;
(5)由图可知,横坐标为$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=2时,尿素的体积分数最大,且氨气的转化率为80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始浓度(mol.L-1 ) 1 0.5 0 0
变化浓度(ol.L-1 ) 0.8 0.4 0.4 0.4
平衡浓度(mol.L-1 ) 0.2 0.1 0.4 0.4
该条件下反应的平衡常数K=$\frac{c(CO(N{H}_{2})_{2}•c({H}_{2}O)}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$=$\frac{0.4×0.4}{0.{2}^{2}×0.1}$=40,
故答案为:2;40;
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学反应能量变化图象分析,平衡标志、平衡常数和平衡计算的判断计算是解题关键,题目难度中等.

| A. | 使酚酞试液呈红色的溶液中:K+、Na+、SO42-、NO3- | |
| B. | 使pH试纸呈红色的溶液中:Fe3+、Na+、SCN-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、AlO2-、SO42-、NO3- | |
| D. | 加入Al粉能产生H2的溶液中:K+、Na+、AlO2-、CO32- |
| A. | FeCl3 | B. | FeCl2 | C. | Fe3O4 | D. | CuCl2 |
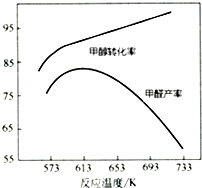 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
?CO(g)+2H2(g)?CH3OH(g)?CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
甲醇与CO的结构式分别如图:
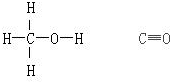
(1)已知反应?中相关化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)温度为110℃条件下,向体积2L的密闭容器充2molCO2与4molH2,发生反应?,10min后达到平衡状态后测得甲醇浓度为0.5mol.L-1.求氢气的反应速率:0.15mol/(L•min).
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
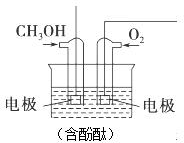
通入甲醇的电极是负(填“正”或“负”)极,反应时该电极附近的现象是溶液红色变浅,溶液中K+向正(填“正”或“负”)极移动:写出正极反应式:O2+2H2O+4e-=4OH-;若电池工作过程中通过2mol电子,则理论上消耗O211.2L(标准状况).