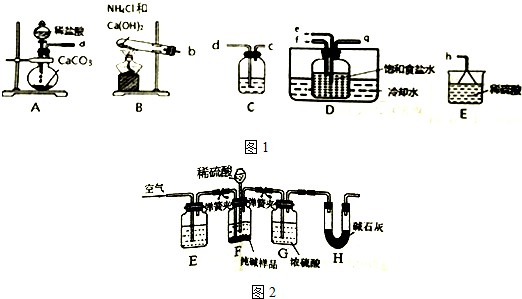
题目内容
14.如表是元素周期表短周期的一部分: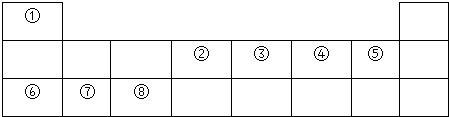
(1)①~⑧元素中金属性最强的元素位于周期表第三周期IA族.
(2)表中元素⑧的原子结构示意图为
 .
.(3)⑤与⑦形成的常见化合物的化学键的类型为离子键,用电子式表示该化合物的形成过程为
 .
.(4)②与④形成的三原子分子的电子式是
 ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.(5)表中元素①、②、③、⑥、⑦中,原子半径由大到小的顺序是⑥>⑦>②>③>①(填序号).
分析 由元素在周期表的位置可知,①~⑧分别为H、C、N、O、F、Na、Mg、Al,
(1)金属性最强的元素为Na;
(2)元素⑧为Al,原子结构中有3个电子层,各层电子数分别为2、8、3;
(3)⑤与⑦形成的常见化合物为MgF2,只含离子键;
(4)②与④形成的三原子分子为CO2;④与⑥形成的原子个数比为1:1的化合物为Na2O2;
(5)电子层越多,原子半径越大;同周期从左向右原子半径减小.
解答 解:由元素在周期表的位置可知,①~⑧分别为H、C、N、O、F、Na、Mg、Al,
(1)金属性最强的元素为Na,位于周期表中第三周期IA族,故答案为:三;IA;
(2)元素⑧为Al,原子结构中有3个电子层,各层电子数分别为2、8、3,则Al的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)⑤与⑦形成的常见化合物为MgF2,只含离子键,电子式表示该化合物的形成过程为 ,
,
故答案为:离子键; ;
;
(4)②与④形成的三原子分子为CO2,电子式为 ,由分子构成,属于分子晶体;④与⑥形成的原子个数比为1:1的化合物为Na2O2,电子式为
,由分子构成,属于分子晶体;④与⑥形成的原子个数比为1:1的化合物为Na2O2,电子式为 ,含离子键、共价键,属于离子晶体,
,含离子键、共价键,属于离子晶体,
故答案为: ;分子晶体;
;分子晶体; ;离子晶体;
;离子晶体;
(5)电子层越多,原子半径越大;同周期从左向右原子半径减小,则①、②、③、⑥、⑦中,原子半径由大到小的顺序是⑥>⑦>②>③>①,
故答案为:⑥>⑦>②>③>①.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识的使用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
17.常温下,与100mL0.10mol/LMgCl2溶液中Cl-浓度相等的是( )
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
19.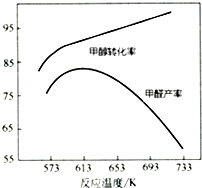 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
(1)计算△H=-155.7kJ•mol-1.
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
3.下列图示与对应的叙述相符的是( )
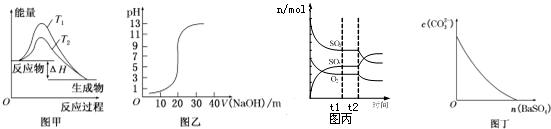

| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |