题目内容
9.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物.请回答下列问题:
(1)D位于元素周期表第三周期ⅠA族.
(2)C和E两元素相比较,非金属性较强的是氧(填元素名称),可以验证该结论的是CD(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式为OH-+H+=H2O;
(5)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为H++HSO3-=H2O+SO2↑.
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;
E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;
E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则E为S;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,
(1)D是Na位于元素周期表第三周期,ⅠA族,故答案为:三;ⅠA;
(2)氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性等来判断,氢化物沸点、单质的状态都属于物理性质,不能比较非金属性强弱,故AB错误、CD正确,
故答案为:氧; CD;
(3)C、D两元素形成的原子个数比为1:1的化合物为Na2O2与水反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)A与C间可形成负一价双原子阴离子,有10个电子,为OH-离子,该阴离子与盐酸反应的离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O;
(5)A、C、D、E四种元素分别为H、O、Na、S,可形成两种酸式盐,为NaHSO4、NaHSO3,两种酸式盐相互反应的离子方程式为:H++HSO3-=H2O+SO2↑,
故答案为:H++HSO3-=H2O+SO2↑.
点评 本题考查位置结构性质的应用,为高考常见题型,侧重于学生的分析能力的考查,掌握元素单质化合物的性质来推断元素是解答本题的关键,学生只要熟悉常见的化合物即可解答,题目难度中等.

 寒假学与练系列答案
寒假学与练系列答案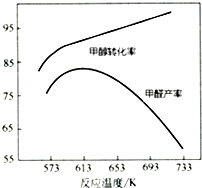 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
| A. | BaSO4粉末可用作钡餐,是因为BaSO4为非电解质 | |
| B. | 有机物苯、乙醇、蔗糖都属于非电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 固态共价化合物不导电,熔融态的共价化合物都可以导电 |
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.5mol/L | D. | 2mol/L |
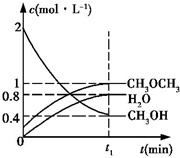 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1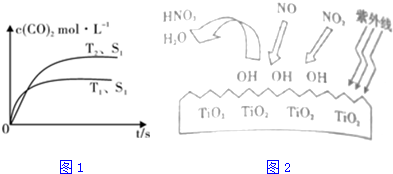
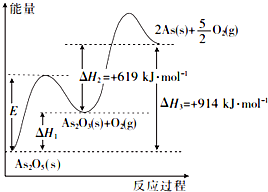 砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题: