题目内容
14. 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.(1)甲用pH试纸测出0.010mol•L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一方法是否正确?是 (填“正确”或“不正确”),并说明理由0.01mol•L-1氨水的pH为10,说明c(OH-)=10-4mol/L,NH3•H2O没有完全电离;
(2)乙取出10mL 0.010mol•L-1氨水,用pH试纸测其pH为a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH为b,若要确认NH3•H2O是弱电解质他认为只要a、b满足什么关系?a-2<b<a;
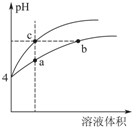
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体 积变化的曲线图中abc三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:①该温度下水的离子积常数Kw=10-12(mol/L)-2;
②在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=11.
分析 (1)根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
(2)利用假设法分析,假设是强碱,稀释100倍后,溶液的pH减小2个单位,如果是弱碱,稀释100倍后,溶液的pH减小的小于2个单位;
(3)pH相等的醋酸和盐酸溶液中,加水稀释促进醋酸电离,氯化氢完全电离,所以稀释相同的倍数后,pH变化大的是盐酸,变化小的是醋酸;
酸抑制水电离,酸的酸性越强,水的电离程度越小;
加水稀释醋酸,促进醋酸电离,溶液中除了氢氧根离子、水分子外,所有微粒浓度都减小;
(4)①溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;
②根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH.
解答 解:(1)如果氨水是强碱,0.01mol•L-1氨水的pH为10,说明c(OH-)=10-4mol/L,NH3•H2O没有完全电离,所以氨水是弱碱;
故答案为:是;0.01mol•L-1氨水的pH为10,说明c(OH-)=10-4mol/L,NH3•H2O没有完全电离;
(2)若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即c(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a,
故答案为:a-2<b<a;
(3)pH相等的醋酸和盐酸溶液中,加水稀释促进醋酸电离,氯化氢完全电离,所以稀释相同的倍数后,pH变化大的是盐酸,变化小的是醋酸,酸抑制水电离,酸的酸性越强,水的电离程度越小,所以溶液体积越大,水的电离程度越大,则水的电离程度由a、b、c三点溶液中水的电离程度由大到小的顺序是b=c>a;加水稀释醋酸,促进醋酸电离,溶液中除了氢氧根离子、水分子外,所有微粒浓度都减小,
a.溶液中c(H+)减小,故a正确;
b.温度不变,水的离子积常数不变,氢离子浓度减小,则c(OH-)增大,故b错误;
c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$,温度不变,水的离子积常数不变、醋酸的电离平衡常数不变,所以$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变,故c错误;
d.加水稀释促进醋酸电离,则氢离子个数增大,醋酸分子个数减小,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故d正确;
故答案为:b=c>a;a d;
(4)①溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12,
故答案为:10-12;
②酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度=$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,溶液中氢离子浓度为10-11mol/L,则溶液的pH=11,
故答案为:11.
点评 本题考查了弱电解质的电离平衡及其影响、酸碱混合的定性判断及pH的计算,题目难度中等,明确影响电离平衡的因素为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的分析能力及灵活应用能力.

| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5 NA | |
| B. | 0.5 NA个氯气分子的物质的量是0.5mol | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 0.1 mol•L-1稀硫酸中含硫酸根个数为0.1NA |
| A. | 7.8g Na2O2中含有的阴离子数目为0.2 NA | |
| B. | 0.1mol Fe与足量稀HNO3反应,转移电子数为0.3NA | |
| C. | 1L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| D. | 标准状况下,2.24L CHCl3的分子数为0.1 NA |
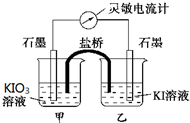 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )| A. | 两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态 | |
| B. | 两次实验中,盐桥中的阳离子移动方向相反 | |
| C. | 开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝 | |
| D. | 向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应 |
| A. | HCl | B. | CH3COO- | C. | SO42- | D. | Fe3+ |
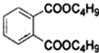 +2NaOH$\stackrel{加热}{→}$
+2NaOH$\stackrel{加热}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.