题目内容
6.NA表示阿伏加德罗常数.下列说法正确的是 (?)| A. | 7.8g Na2O2中含有的阴离子数目为0.2 NA | |
| B. | 0.1mol Fe与足量稀HNO3反应,转移电子数为0.3NA | |
| C. | 1L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| D. | 标准状况下,2.24L CHCl3的分子数为0.1 NA |
分析 A、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含1mol过氧根来分析;
B、铁与足量的稀硝酸反应后变为+3价;
C、铝离子是弱碱阳离子,在溶液中会水解;
D、标况下氯仿为液体.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠中含1mol过氧根,故0.1mol过氧化钠中含0.1mol过氧根即0.1NA个,故A错误;
B、铁与足量的稀硝酸反应后变为+3价,故0.1mol铁转移0.3mol电子即0.3NA个,故B正确;
C、铝离子是弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于0.2NA个,故C错误;
D、标况下氯仿为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
16.甲烷和氨在国民经济中占有重要地位.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
①反应热△H(填“>”、“<”或“=”)<0.
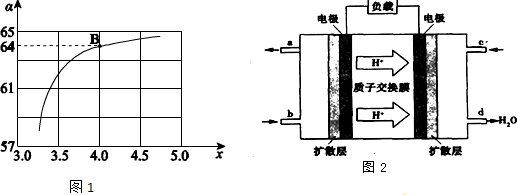
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.
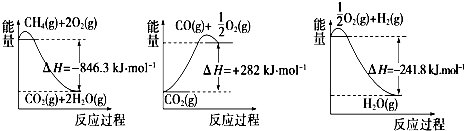
(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.

(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
11.氨是最重要的化工产品之一.
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①你认为该溶液呈碱(填“酸”、“中”或“碱”性).
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
18.碳酸锰,俗称“锰白”,是生产电讯器材软磁铁氧体的原料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,工业上有广泛的用途.工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图1:

已知:几种金属离子沉淀的pH如表回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC.
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为15.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
②再加入石灰的目的是3.7~5.2.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=1.5×10ˉ10(mol3•L-3).
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②pH越大越有利于提升MnCO3的产率.
(6)副产品A的主要成分是(NH4)2SO4.

已知:几种金属离子沉淀的pH如表回答下列问题:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为15.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
②再加入石灰的目的是3.7~5.2.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=1.5×10ˉ10(mol3•L-3).
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②pH越大越有利于提升MnCO3的产率.
(6)副产品A的主要成分是(NH4)2SO4.
10.科学家从(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子.下列说法正确的是( )
| A. | N4与N2互为同位素 | |
| B. | N4H44+与NaOH溶液反应的离子方程式为N4H44++4OH-═N4+4H2O | |
| C. | N4H4(SO4)2为弱电解质 | |
| D. | N4H44+中只含有极性共价键,不含非极性共价键 |
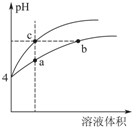 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.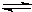 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.