题目内容
4.将一定量的CO2 通入下列溶液中①BaCl2溶液 ②澄清的石灰水 ③饱和Na2CO3溶液 ④K2SiO3溶液;可能变浑浊的是:( )| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
分析 ①碳酸不能与强酸盐BaCl2反应生成强酸和弱酸盐;
②石灰水与CO2反应生成碳酸钙沉淀;
③碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3;
④CO2与K2SiO3反应生成硅酸.
解答 解:①因酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐.像本选项中碳酸不能与强酸盐BaCl2反应生成强酸和弱酸盐,所以自始至终也不出现浑浊,故①错误;
②石灰水与少量CO2反应生成碳酸钙沉淀,故②正确;
③因碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3,溶剂水减少,生成的碳酸氢钠质量比碳酸钠多,故最终有碳酸氢钠析出而使溶液变浑浊,故③正确;
④CO2与K2SiO3反应生成硅酸,生成沉淀,故④正确.
故选D.
点评 本题考查了CO2的相关性质,酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐.但要注意在酸与盐反应的问题上有些特例,如CuSO4+H2S═CuS↓+H2SO4.

练习册系列答案
相关题目
19.下列有关工业生产的叙述中错误的是( )
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
16.甲烷和氨在国民经济中占有重要地位.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
①反应热△H(填“>”、“<”或“=”)<0.
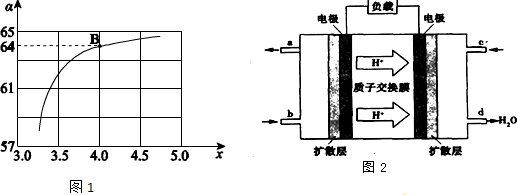
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.
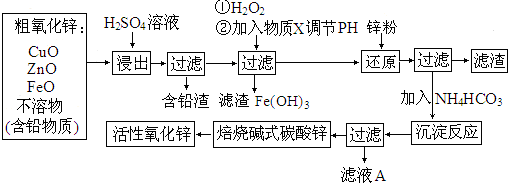
(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系.求图1中的B点处,NH3的平衡转化率32%.

(3)已知甲烷燃料电池的工作原理如图2所示.该电池工作时,a口放出的物质为CO2,该电池正极的电极反应式为:O2+4e-+4H+=2H2O,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有1.6mol 电子发生转移.

 为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
为了证明一水合氨(NH3•H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.