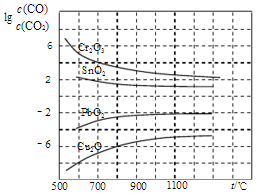
题目内容
9.用NA表示阿伏伽德罗常数的值,下列有关说法不正确的是( )| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |
分析 A、求出混合物的物质的量,然后根据氮气和CO的摩尔质量均为28g/mol来计算;
B、金属和酸反应时,氢元素的价态由+1价变为0价;
C、过氧化钠由2个阳离子和1个阴离子构成;
D、一水合氨为弱电解质,在溶液中能部分电离.
解答 解:A、标况下22.4L混合物的物质的量为1mol,而氮气和CO的摩尔质量均为28g/mol,故1mol混合物的质量为28g,故A正确;
B、金属和酸反应时,氢元素的价态由+1价变为0价,故当生成2g氢气即1mol氢气时,转移2NA个电子,故B正确;
C、过氧化钠由2个阳离子和1个阴离子构成,故含0.2NA个阴离子即0.2mol阴离子的过氧化钠的物质的量为0.2mol,而过氧化钠和水反应时,1mol过氧化钠转移1mol电子,故0.2mol过氧化钠转移0.2NA个电子,故C正确;
D、一水合氨为弱电解质,在溶液中能部分电离,故1L含NA个NH3•H2O的氨水,其浓度大于1mol•L-1,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 50mL 1 mol•L-1 NaCl溶液 | B. | 100mL2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL1 mol•L-1 NH4Cl溶液 | D. | 150mL2 mol•L-1 KCl溶液 |
17.自然界为人类提供了多种多样的营养物质,下列有关说法不正确的是( )
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
4.某结晶水合物的化学式为R.xH2O其相对分子质量为M,在25℃时ag晶体溶于bg水中,即达饱和,形成VmL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
1.下列反应的离子方程式中,正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
6.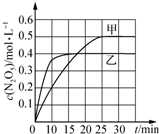 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
下列说法正确的是( )
 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物 | |||
| 起始量 | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| 温度/K | T1 | T2 | T2 |
| A. | 0~10 min内甲容器中反应的平均速率:v(NO2)=0.02 mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1K时,若起始时向容器甲中充入2 mol NO2、1 mol O3、2 mol N2O5和2 mol O2,则脱硝反应达到平衡前,v(正)<v(逆) |
7. 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义.
已知:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0.
②合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v(正)>v(逆)(填“>”、“<”或“=”).生产过程中,合成气要进行循环,其目的是提高原料的利用率.
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)?CH3OH(g) 中CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图(如图).
①B极为电池负极,电极反应式为CH4+4O2--8e-=CO2+2H2O.
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为1.12 L(标况下).
 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义.
已知:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0.
②合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.20 | 0.10 | 0.40 |
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)?CH3OH(g) 中CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图(如图).
①B极为电池负极,电极反应式为CH4+4O2--8e-=CO2+2H2O.
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为1.12 L(标况下).
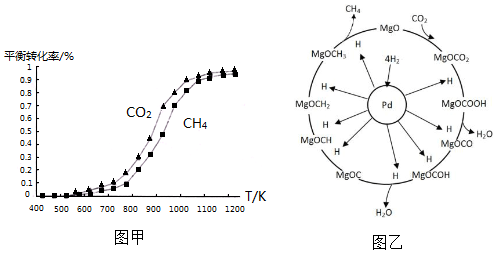 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.