题目内容
19.数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:I、CH4(g)═C(s)+2H2(g)△H=+75.0kJ•mol-1
II、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ•mol-1
III、CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ•mol-1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=+247kJ•mol-1.
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲.
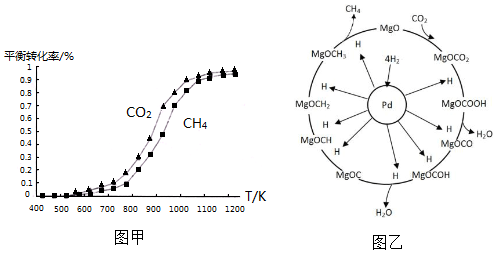 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是△S>0.
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为CO2+4H2
 CH4+2H2O.
CH4+2H2O.(4)CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.下列说法正确的是BC.
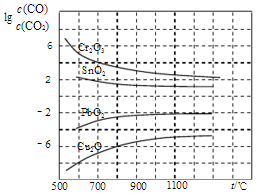
A.工业上可以通过增高反应装置来延长矿石和
CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于
提高CO的利用率
D.CO还原PbO2的反应△H>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2$\frac{\underline{\;通电\;}}{\;}$2CO+O2,则其阳极的电极反应式为4OH--4e-=O2↑+2H2O.
分析 (1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
根据盖斯定律①+②-③可得;
(2)①根据图示可以看出,CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0;
(3)根据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”结合反应机理来书写方程式并结合化合价判断;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0;
(5)依据电解原理阴极上是得到电子发生还原反应生成一氧化碳.
解答 解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
根据盖斯定律①+②-③得到反应CO2(g)+CH4(g)═2CO(g)+2H2(g),△H=+247kJ/mol;
故答案为:+247;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;
故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行;
故答案为:△S>0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2 CH4+2H2O;
CH4+2H2O;
故答案为:CO2+4H2  CH4+2H2O;
CH4+2H2O;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合B正确;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高,故C正确;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0,故D错误;
故答案为:BC;
(5)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2$\frac{\underline{\;电解\;}}{\;}$2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O;
故答案为:4OH--4e-=O2↑+2H2O.
点评 本题主要考查了盖斯定律的应用、电极方程式及其化学方程式的书写、根据图象对平衡移动的判断等,重在培养学生能够利用化学知识提取题干的信息进行答题的能力,综合性强,难度较大.

(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 硫酸铜溶液 | D. | 蔗糖溶液 |
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |