题目内容
14.目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2.己知物质A、B、C、D、E、F 有如图所示转化关系:
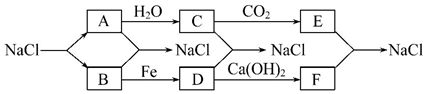
请按要求书写:
(1)A→C的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)B→D 的化学方程式2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(3)E+F→NaCl的离子方程式Ca2++CO32-=CaCO3↓.
(4)过氧化钠可用作制氧剂,写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
分析 由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,然后结合元素化合价知识及化学用语来解答.
解答 解:由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,
(1)由上述分析可知,A为Na,B为Cl2,C为NaOH,D为FeCl3,E为Na2CO3,F为CaCl2,A→C的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2;
(2)B→D 的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)E+F→NaCl的离子方程式为:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(4)过氧化钠可用作制氧剂,过氧化钠与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、氯气的性质是解答本题的关键,注意物质之间的转化即可解答,题目难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
5.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | KClO3发生还原反应 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | 每生成1 mol ClO2,转移的电子数约为6.02×1023 |
9.用NA表示阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |
19.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
6.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中的碳原子有sp3和sp2两种杂化类型 | |
| C. | 丙烯分子的所有原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
11.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=1.975;2.00min~5.00min内,O2的平均反应速率为0.055mol•L-1•min-1.
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
请写出NO和CO反应的热化学方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5kJ•mol-1.
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是a.
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2之间存在反应:N2O4(g)?2NO2(g)△H=QkJ•mol-l.将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.

如图1中a点对应温度下,已知N2O4的起始压强p0为200kPa,该温度下反应的平衡常数Kp=213.3KPa(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图2所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入溶液的氢氧化钠的物质的量0.099mol.
12. 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇(CH3OH)蒸汽和水蒸气CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示恒压容器中充入1mol CO2和3mol H2,转化率达50%时放出热量19.6KJ写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-39.2 kJ•mol-1.
(2)另外工业上还可用CO和H2制备甲醇. 反应为CO(g)+2H2(g)═CH3OH(g),某温度下,在容积为2L的恒容密闭容器中进行该反应,其相关数据如图:t min至2t min时速率变化的原因可能是升温或使用了催化剂;
(3)CO2在一定条件下,还可以与H2合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).
将2.5mol H2与b mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得实验数据如表:
①降温时,上述平衡向正反应方向移动(填“正反应”或“逆反应”).
②表中y、z的大小关系为B.
A.y=z B.y>z C.y<z D.无法判断
③表中x、y、z、w对应的平衡常数分别为Kx、Ky、Kz、Kw,它们之间的大小关系为Kx>Kz>Ky=Kw.
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇(CH3OH)蒸汽和水蒸气CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示恒压容器中充入1mol CO2和3mol H2,转化率达50%时放出热量19.6KJ写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-39.2 kJ•mol-1.
(2)另外工业上还可用CO和H2制备甲醇. 反应为CO(g)+2H2(g)═CH3OH(g),某温度下,在容积为2L的恒容密闭容器中进行该反应,其相关数据如图:t min至2t min时速率变化的原因可能是升温或使用了催化剂;
(3)CO2在一定条件下,还可以与H2合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).
将2.5mol H2与b mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得实验数据如表:
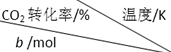 | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
②表中y、z的大小关系为B.
A.y=z B.y>z C.y<z D.无法判断
③表中x、y、z、w对应的平衡常数分别为Kx、Ky、Kz、Kw,它们之间的大小关系为Kx>Kz>Ky=Kw.
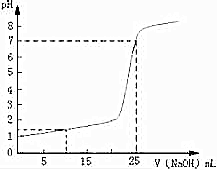 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示: