��Ŀ����
1��ʵ���Ҳ��ü���װ��ģ�ҵ����ԭ����ʵ��װ����ͼ��ʵ�鲽�����£�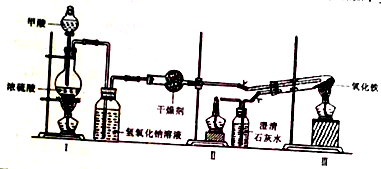
�ٰ�ͼ���Ӻ�װ�ã����װ�������ԣ�
�ڳ�ȡ0.2000gFe2O3��ʯӢ�Թ��У���ȼI���ƾ��ƣ���������״���
�������ij�������ȼ���������ƾ��ƣ�
��30min��ֹͣ���ȣ��رյ��ɼУ�
�ݴ�������ȴ�����º��ռ����
�������Ϸ����ֱ��ռ����������־ƾ��ƣ��������ֿ��Լ��л��桢����¶ȣ��;ƾ���Ƽ��ȵIJ��
��ش��������⣺
��1���Ʊ�CO��ԭ�������ü״���HCOOH����Ũ������������µķֽ��Ƶã�д���÷�Ӧ�Ļ�ѧ����ʽHCOOH $��_{��}^{Ũ����}$CO��+H2O��
��2��ʵ�鲽���Ӧ�ڼ���CO���Ⱥ��ȵ�ȼII���II����III�������ƾ��ƣ�
��3��ʵ�鲽��ݲ�����ȴ������ʱӦע�����ͨ��CO���������������
��4����֪FeO��Fe2O3��Fe3O4����Ԫ�ص����������ֱ�Ϊ��22.2%��30%��27.6%���������������3����Ʒ����Ԫ�������Ԫ�ص������������±���������Ԫ�ص�����������֪ǰ���ּ��ȷ�ʽ�õ��IJ���Ϊ�������оƾ��Ƽ������ò������������9�֣�
| ���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������/% | |
| Fe | O | ||
| �ƾ��� | Fe��O | 74.50 | 25.50 |
| �����־ƾ��� | Fe��O | 76.48 | 23.52 |
| �ƾ���� | Fe | 100.00 | 0.00 |
��6��ͨ�������ϻ�ȡ������Ϣ��I���ƾ���ƽ���¶�Ϊ600�棬�����־ƾ���ƽ���¶�Ϊ700�棬�ƾ���ƽ���¶�Ϊ930�森II������ָ������Ӧ�¶ȸ���710��Fe���ȶ����ڣ�680�桫710��֮�䣬FeO�ȶ����ڣ�����680�棬����Ҫ��Fe3O4���Է����ƾ��Ƽ�������������Fe��ԭ���dz�ʱ�伯�м���ʹ�ֲ��¶ȴﵽ��ԭ����������Ҫ���¶ȣ�����Fe�Ĺ����з��������з�Ӧ�Ļ�ѧ����ʽ3Fe2O3+CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe3O4+CO2��Fe3O4+CO$\frac{\underline{\;\;��\;\;}}{\;}$3FeO+CO2��Fe2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
���� ��1������װ��ͼ��֪�Ʊ�һ����̼��ԭ��Ϊ������Ũ������������·ֽ⣬HCOOH�ֽ�����CO��ˮ��
��2��CO��������ϼ����ױ�ը�����Ե�ȼǰҪ���鴿�ȣ�����һ����̼�Ŀ�ȼ�ԺͶ��������з�����ȼ���Ⱥ�
��3�����¶Ƚϸ�ʱ��������������Ӧ�������ͨ��һ����̼�������������
��4��Fe��FeO��Fe2O3��Fe3O4��FeԪ�صİٷֺ����ֱ�Ϊ100%��77.8%��70%��72.4%����ϱ��е������ж����ʵ���ɣ�
��5�����ݾƾ��Ƽ��ȵõ��IJ���ΪFe3O4��Fe������Ԫ�صİٷֺ���Ϊ74.50%����Fe3O4������Ϊx��Fe������Ϊy���������������������㣻
��6���ƾ��ƵĻ���ƽ��600�ȣ������ܴﵽ���ȶ����ڵ��¶ȣ����ǣ���ʵ�ʲ��������У��������ȼ�ɢ�ȵ����⣬����־ֲ��¶Ƚϸߵ���������Fe�Ĺ����з����ķ�Ӧ��һ����̼������������������������һ����̼��������������Ӧ��������һ����̼�����������������ݴ���д����ʽ��
��� �⣺��1����Ũ������������£�HCOOH�ֽ�ɵ�CO�����������غ��֪��һ������Ϊˮ����Ӧ�Ļ�ѧ����ʽΪ��HCOOH $��_{��}^{Ũ����}$CO��+H2O��
�ʴ�Ϊ����Һ©����HCOOH $��_{��}^{Ũ����}$CO��+H2O��
��2��CO��������ϼ����ױ�ը�����Ե�ȼǰҪ���鴿�ȣ���ʵ�鲽���ij�������ָ����CO���ȣ�Ϊ���ž�װ���ڵĿ����������ȼ�ƾ��Ʒ�����ը������Ҫ��ͨ��һ����̼���壬��һ����̼�ж�������ֱ���ŷŵ������У�Ӧ�����ȼ����������ʵ�鲽��ۺ�Ҫ�ȵ�ȼII���ľƾ��ƣ�
�ʴ�Ϊ������CO���ȣ�II��
��3��Ϊ��ֹ�������Ļ�ԭ�ɲ������¶Ƚϸ�ʱ������е�������Ӧ��ʵ�鲽��ݲ�����ȴ������ʱӦע�����ͨ��һ����̼�����������
�ʴ�Ϊ������ͨ��CO���������������
��4��Fe��FeO��Fe2O3��Fe3O4��FeԪ�صİٷֺ����ֱ�Ϊ100%��77.8%��70%��72.4%���ƾ��Ƽ������ò�����FeԪ�صİٷֺ���Ϊ74.50%���������������һ��FeԪ�غ�������74.50%��������һ��FeԪ�غ���С��74.50%���ʻ������һ����Fe��FeO�е�����һ�֣�Ҳһ����Fe2O3��Fe3O4�е�һ�֣�
�������ʻ�ϵ���Fe��Fe2O3��Fe��Fe3O4��FeO��Fe2O3��FeO��Fe3O4 ��4����ϣ�
�������ʻ�ϵ���Fe��Fe2O3��Fe3O4��FeO��Fe2O3��Fe3O4��Fe2O3��Fe��FeO��Fe3O4��Fe��FeO��4����ϣ�
�������ʻ�ϵ���Fe��FeO��Fe2O3��e3O4ֻ��1�֣���9����ϣ�
�ʴ�Ϊ��9��
��5�����ݾƾ��Ƽ��ȵõ��IJ���ΪFe3O4��Fe������Ԫ�صİٷֺ���Ϊ74.50%����Fe3O4������Ϊx��Fe������Ϊy����$\frac{x��\frac{168}{232}+y}{x+y}$��100%=74.50%��
��ã�$\frac{x}{y}$=12��1��
�ʴ�Ϊ��12��
��6������Ӧ�¶ȸ���710�棬Fe���ȶ����ڣ��ƾ��ƵĻ���ƽ��600�ȣ������ܴﵽ���ȶ����ڵ��¶ȣ����ǣ���ʵ�ʲ��������У��������ȼ�ɢ�ȵ����⣬��ʱ�伯�м��Ȼ���־ֲ��¶Ƚϸߵ����ﵽ��ԭ����������Ҫ���¶ȣ��ڼ��ȵ������£�����Fe�Ĺ����з�����3Fe2O3+CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe3O4+CO2��Fe3O4+CO$\frac{\underline{\;\;��\;\;}}{\;}$3FeO+CO2��Fe2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
�ʴ�Ϊ����ʱ�伯�м���ʹ�ֲ��¶ȴﵽ��ԭ����������Ҫ���¶ȣ�3Fe2O3+CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe3O4+CO2��Fe3O4+CO$\frac{\underline{\;\;��\;\;}}{\;}$3FeO+CO2��Fe2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
���� ���⿼�����ʵ��Ʊ�ʵ�顢ʵ�鷽����ơ����ʺ����IJⶨ�ȣ���Ŀ�Ѷ��еȣ���ȷʵ��ԭ���ǽⱾ��ؼ����������ʵ����ʷ������ע��Ԫ�ػ�����֪ʶ�Ļ��ۺ�������ã�

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�| A�� | ʹ�ú����Ȼ��Ƶ���ѩ������������ĸ�ʴ | |
| B�� | ���ڳ����ڱ�����������һ�ַ�ɢϵ��������̼���ֵ�ԭ������������ | |
| C�� | �����������°��������ȳ������������������������Ա����������� | |
| D�� | �ҹ����ֳ������ƹ�ʹ�õġ��״����͡��н����ŷŷ������ŵ㣬���κθ������� |
| A�� | ������������Ȼ�̼��Һ | B�� | ��������Һ�巴Ӧ | ||
| C�� | ��ȼ | D�� | ��һ���������������ӳ� |
��1������β����CO��NO2������һ�������¿��Է�����Ӧ��
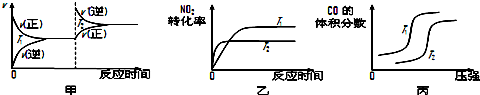
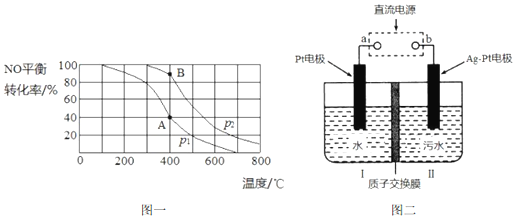
4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-1200kJ•mol-1�����º��������£�����˵���÷�Ӧ�Ѵﵽƽ��״̬����CD������ţ���
A�������ڻ��������ɫ���ٱ仯 B�������ڵ�ѹǿ���ֲ���
C��2v����NO2��=v����N2�� D�������ڻ�������ܶȱ��ֲ���
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ�����ң�����ţ���
����β����CO��H2O��g����һ�������¿��Է�����Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0�� ij�¶�ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=81��
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
��3����֪�¶�ΪTʱ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+165KJ•mol
CO��g��+H2O��g��=CO2��g��+H2��g����H=-41KJ•mol������Ͻ�ThNi5�ɴ���CO��H2�ϳ�CH4�ķ�Ӧ���¶�ΪTʱ���÷�Ӧ���Ȼ�ѧ����ʽ��CO��g��+3H2��g��=CH4��g��+H2O��g����H=-206kJ•mol?1��
| A�� | �ü��������ˮ�����˵ķ�����ȥNaCl��Һ�л��е�AlCl3 | |
| B�� | ��ȥNaCl��Һ��������Na2S������AgCl���ٹ��� | |
| C�� | ��MgCl2��Һ�м���CaCO3��ĩ����ֽ������˿ɳ�ȥ����FeCl3 | |
| D�� | ��ȥFeCl3��Һ��������CuCl2�������������ۣ����� |
| A�� | ��Ҫ����NaClO���������Ϊ144.0 g | |
| B�� | ��ͼ��ʾ�������У��������Dz���Ҫ�ģ������һ�ֲ������� | |
| C�� | ���Ƶ���Һ�ڿ����й��գ����ú���Һ��NaClO�����ʵ���Ũ�ȼ�С | |
| D�� | ����ƿ������ˮϴ����Ӧ��ɲ���������Һ���ƣ�������ƫ�� |
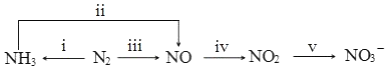
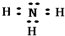 ��
��
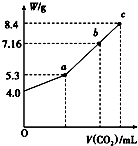 ��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺