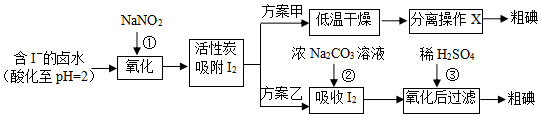
题目内容
6.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体CO2和N2等.(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1.恒温恒容条件下,不能说明该反应已达到平衡状态的是CD(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
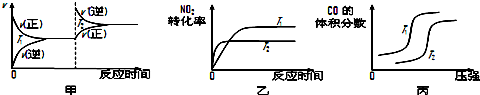
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
(3)已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol.贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式是CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol?1.
分析 (1)根据化学平衡时正逆反应速率相等,各组分含量保持不变分析;根据影响化学平衡移动的因素以及化学平衡移动的方向来判断即可,根据影响化学反应速率的因素:温度、浓度、压强、催化剂来确定化学反应达平衡用到的时间,根据影响化学平衡移动的因素:温度、浓度、压强来确定化学平衡中各个量的变化情况;
(2)根据化学平衡三段式列式计算化学反应中物质的转化率;根据影响化学平衡移动的因素以及化学平衡移动的方向来判断即可;
(3)已知温度为T时:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol
根据盖斯定律②-①得CO(g)+3H2(g)=CH4(g)+H2O(g),据此计算.
解答 解:(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1,
A.容器内混合气体颜色不再变化时,气体浓度不变,达到平衡,A正确,
B.该反应是个气体体积减小的反应,恒容时压强压强会减小,容器内的压强保持不变时,反应到达平衡,B正确,
C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO2)=2v正(N2),C错误,
D.恒容体积不变,混合气体的质量不变,容器内混合气体密度保持不变,不能说明反应到达平衡,D错误,
甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误,
乙:升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确,
丙:对于反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误;
故答案为:CD;乙;
(2)令密闭容器体积为1L,甲容器,设转化CO为x:
CO(g)+H2O(g)?CO2(g)+H2(g)
c始:0.1 0.1 0 0
c转:x x x x
c平:0.1-x 0.1-x x x
则K=$\frac{{x}^{2}}{(0.1-x)^{2}}$=81,解得x=0.09,则CO的转化率为$\frac{0.09}{0.1}×100%$=90%;由于乙中水的物质的量增加,水的浓度增大,其他条件不变,增大某物质的浓度,可以使其他物质的转化率增大,而本身的转化率减小,所以水的转化率,乙<甲,由于该反应是和气体体积不变的反应,所以增大压强化学平衡不移动,故水的转化率,丙=甲;
故答案为:90%;<;=;
(3)已知温度为T时:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol
根据盖斯定律②-①得CO(g)+3H2(g)=CH4(g)+H2O(g),△H=-206kJ•mol?1;
故答案为:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol?1.
点评 本题目综合考查化学反应速率和化学平衡移动的影响因素以及有关化学平衡的转化率、平衡常数的计算、盖斯定律等方面的知识,题目难度中等,注意明确影响化学平衡的因素,掌握化学平衡常数的概念及计算方法.

| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
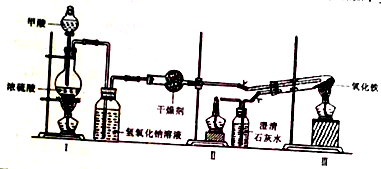
①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
| 糖类 | 油脂 | 蛋白质 | 其他 | |
| 花生米 | 24% | 39% | 26% | 11% |
| 小麦 | 76% | 2% | 11% | 11% |
(1)比较500g小麦和500g花生米的能量大小.(假设能量能被完全释放)
(2)我们平时所吃的植物油之一就是花生油.将花生米加工后用机器压榨,约有85%的油脂可成为商品花生油.某食品厂购买了100吨花生米,他们可生产多少吨商品花生油?
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.