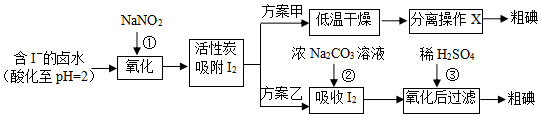
题目内容
8.氮及其化合物在生产生活中应用广泛,其转化关系如图所示: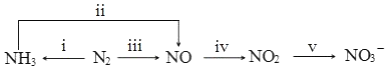
(1)NH3的电子式是
 .
.(2)ii 中 NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28KJ•mol-1
4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H2=-1811.63KJ•mol-1
则4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H3=-1269.02KJ•mol-1
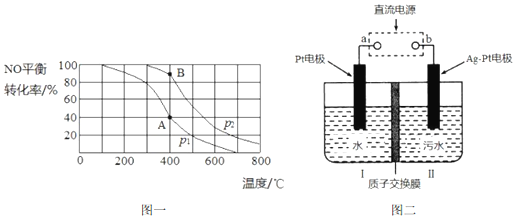
(3)iv中反应 2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如图一所示,则 p1< p2 (填“>”“<”或“=”,下两空同);
该反应的△H<0;A、B 两点的化学反应速率:v(A)<v(B). 已知 400℃时,投入的NO和O2的起始量分别为x mol 和y mol,此时容器体积为V L,A 点的平衡常数 K=$\frac{4V}{9(y-0.2x)}$(用x、y、V表示).
(4)利用电化学降解法治理水中的硝酸盐污染(如图二),电解槽中间用质子交换膜隔开,污水放入II区,通电使NO3-转化为N2,a为电源的正极,Ag-Pt电极上的电极反应式是2NO3-+10e-+12H+=N2↑+6H2O.
分析 (1)根据共价化合物电子式的书写规则书写;
(2)由①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28KJ•mol-1;②4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H2=-1811.63KJ•mol-1,根据盖斯定律可知:△H=(①×3+2×②)×$\frac{1}{5}$,由此分析解答;
(3)相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,则p1<p2;相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,则△H<0;压强大,反应速率大,B点压强是p2,所以v(A)<v(B);根据三行式求平衡常数,
2NO(g)+O2(g)?2NO2(g),
n(初):x mol y mol 0
n(变)0.4x 0.2x 0.4x
n(平)0.6x y-0.2x 0.4x,
所以平衡常数K=$\frac{(\frac{0.4x}{V})^{2}}{(\frac{0.6x}{V})^{2}•\frac{y-0.2x}{V}}$=$\frac{4V}{9(y-0.2x)}$;
(4)污水放入II区,通电使NO3-转化为N2,氮元素的化合价降低发生还原反应是电解池的阴极,所以b是原电池的负极,则Ag-Pt电极上的电极反应式是2NO3-+10e-+12H+=N2↑+6H2O.
解答 解:(1)氨气是共价化合物,各原子间通过共用电子对形成共价键,所以其电子式为 ,故答案为:
,故答案为: ;
;
(2)由①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28KJ•mol-1;②4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H2=-1811.63KJ•mol-1,根据盖斯定律可知:△H=(①×3+2×②)×$\frac{1}{5}$=$\frac{1}{5}$×(-907.28×3-2×1811.63)=-1269.02KJ•mol-1,
故答案为:-1269.02;
(3)相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,则p1<p2,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,则△H<0;压强大,反应速率大,B点压强是p2,所以v(A)<v(B);
2NO(g)+O2(g)?2NO2(g),
n(初):x mol y mol 0
n(变)0.4x 0.2x 0.4x
n(平)0.6x y-0.2x 0.4x,
所以平衡常数K=$\frac{(\frac{0.4x}{V})^{2}}{(\frac{0.6x}{V})^{2}•\frac{y-0.2x}{V}}$=$\frac{4V}{9(y-0.2x)}$,
故答案为:<;<;<;$\frac{4V}{9(y-0.2x)}$;
(4)污水放入II区,通电使NO3-转化为N2,氮元素的化合价降低发生还原反应是电解池的阴极,所以b是原电池的负极,a是电源的正极,则Ag-Pt电极上的电极反应式是2NO3-+10e-+12H+=N2↑+6H2O,
故答案为:正;2NO3-+10e-+12H+=N2↑+6H2O.
点评 本题考查了盖斯定律、化学平衡移动、电解原理,明确阴阳极上发生的电极反应、阴阳极的判断方法等知识点即可解答,难点是电极反应式的书写,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
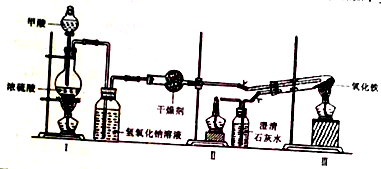
①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
 .
. .
.