题目内容
10.下列有关除杂的实验操作合理的是( )| A. | 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3 | |
| D. | 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤 |
分析 A.氯化铝与氨水反应生成沉淀和氯化铵;
B.Na2S与AgCl发生沉淀的转化;
C.碳酸钙促进氯化铁的水解,生成氯化钙;
D.二者均与Fe反应.
解答 解:A.氯化铝与氨水反应生成沉淀和氯化铵,引入新杂质,故A错误;
B.Na2S与AgCl发生沉淀的转化,过滤可除杂,故B正确;
C.碳酸钙促进氯化铁的水解,生成氯化钙,应加MgO等促进水解,然后过滤,故C错误;
D.二者均与Fe反应,不能除杂,应选氧化铁促进铜离子水解,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法、沉淀的转化、盐类水解、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.实验室采用简易装置模拟工业炼铁原理,实验装置如图,实验步骤如下:
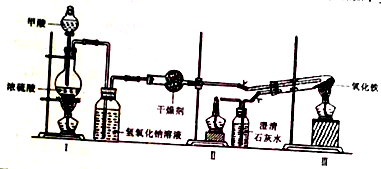
①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
(5)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1(要求保留整数);
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.

①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
15.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:ANa2CO3 BBa(OH)2 DAgNO3
(2)E溶液呈酸性的原因是:(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+).
(4 )在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
2.下列关于物质的用途正确的是( )
| A. | 在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多 | |
| B. | 人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2 | |
| C. | 水玻璃可用于生产粘合剂和防火剂 | |
| D. | 自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用 |
 .
. .
.