题目内容
10.下列说法错误的是( )| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性碳口罩的原理是吸附作用 | |
| C. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 |
分析 A.原电池能加快化学反应的速率;
B.活性炭具有疏松多孔的结构,具有吸附性;
C.亚硝酸钠具有还原性,在国家规定标准内,可以做防腐剂;
D.甲醇可降低污染,但如生成CO等,可污染环境.
解答 解:A.氯化钙为电解质,能与桥梁中的钢构成原电池,发生电化学腐蚀,较快钢铁的腐蚀速率,故A正确;
B.活性炭具有疏松多孔的结构,具有吸附性,则雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理,故B正确;
C.亚硝酸钠具有还原性,在国家规定标准内,可以做防腐剂,可以用于火腿肠中保持肉质新鲜,故C正确;
D.添加甲醇,一般来说可完全燃烧,可降低污染,但如生成CO等,可污染环境,故D错误;
故选D.
点评 本题考查了生活、生产中的化学知识,为高频考点,侧重考查学生双基知识,有利于培养学生良好的科学素养,明确电化学腐蚀的原理、活性炭、甲醇、亚硝酸盐的性质是解题关键,题目难度中等,注意对相关知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列有关气体摩尔体积的描述中正确的是( )
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
1.某小组同学用如下装置电解食盐水,并对电解产物进行探究.
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O;
③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为Cu+.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O;
③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为Cu+.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
5.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
15.下列关于平衡常数的说法中,正确的是( )
| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
2.常温下能共存,且能用浓H2SO4干燥的一组气体是( )
| A. | O2、SO2 | B. | NH3、N2 | C. | NO、O2 | D. | NH3、HCl |
1.实验室采用简易装置模拟工业炼铁原理,实验装置如图,实验步骤如下:
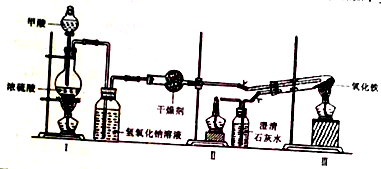
①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
(5)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1(要求保留整数);
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.

①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
 .
. .
.