题目内容
15.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题以此粉末为原料,设计如图工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: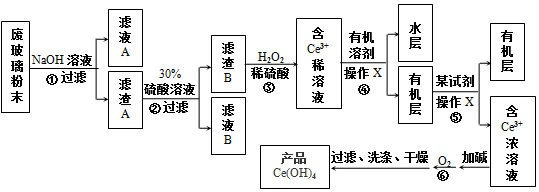
己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II.CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物.
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第六周期.
(2)步骤①、⑥反应的化学方程式分别为2NaOH+SiO2=Na2SiO3+H2O、4Ce(OH)3+O2+2H2O=4Ce(OH)4.
(3)检验滤渣B洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已经洗净.
(4)步骤③的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O.
(5)操作X名称为萃取分液.
(6)在滤液B中加过量铁粉于50°C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾.步骤②中的硫酸溶液过稀会导致反应速率慢、不利于晶体析出;静置冷却一段时间后,在试管中观察到的现象是有浅绿色晶体析出.
(7)取2.08g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为90%.
分析 第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸铁溶液和硫酸亚铁,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步用有机溶剂萃取Ce3+;第⑤步用有机溶剂萃取Ce3+,得到含有Ce3+的浓溶液;第⑥步加碱生成Ce(OH)3悬浊液,Ce(OH)3悬浊液被氧化生成Ce(OH)4.
(1)Ce的原子序数为58,属于镧系元素;
(2)步骤①氢氧化钠与二氧化硅反应生成硅酸钠和水;⑥反应为Ce(OH)3被O2氧化生成Ce(OH)4;
(3)滤液中含有铁离子,检验滤渣B是否洗涤干净,即检验洗液中是否含有铁离子即可;
(4)步骤③中反应为CeO2与H2O2 反应生成Ce3+、O2和H2O;
(5)操作X是用难溶性的有机溶剂提取水中的溶质;
(6)浓度越小,反应速率越慢、增大硫酸根离子的浓度有利于硫酸亚铁的析出;温度降低硫酸亚铁的溶解度减小有晶体析出;
(7)FeSO4的物质的量为0.1000mol/L×90.00mL×10-3=9.0×10-3mol,根据电子得失守恒有关系式FeSO4~Ce(OH)4,求出Ce(OH)4的质量,再计算质量分数.
解答 解:(1)Ce的原子序数为58,属于镧系元素,在周期表中位于第六周期第IIIB族;
故答案为:六;
(2)步骤①氢氧化钠与二氧化硅反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O;⑥反应为Ce(OH)3被O2氧化生成Ce(OH)4,反应的化学方程式为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
故答案为:2NaOH+SiO2=Na2SiO3+H2O;4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(3)滤液中含有铁离子,洗涤滤渣B时洗液中会含有铁离子,检验滤渣B是否洗涤干净,即检验洗液中是否含有铁离子即可,其操作为:取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已经洗净;
故答案为:取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已经洗净;
(4)步骤③中反应为CeO2与H2O2 反应生成Ce3+、O2和H2O,反应的离子方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(5)操作X是用难溶性的有机溶剂提取水中的溶质,即萃取分液;
故答案为:萃取分液;
(6)步骤 ②中的硫酸溶液过稀会导致反应速率慢、不利于晶体析出,静置冷却一段时间后,温度降低硫酸亚铁的溶解度减小,所以在试管中观察到的现象是有浅绿色晶体析出;
故答案为:反应速率慢、不利于晶体析出;有浅绿色晶体析出;
(7)FeSO4的物质的量为0.1000mol/L×90.00mL×10-3=9.0×10-3mol,根据电子得失守恒有关系式FeSO4~Ce(OH)4,所以取2.08g产品中Ce(OH)4的质量为9.0×10-3mol×208g/mol=1.872g,所以产品中Ce(OH)4的质量分数为$\frac{1.872g}{2.08g}$×100%=90%,
故答案为:90%.
点评 本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,题目难度中等,明确实验流程及反应原理为解答关键,试题有利于培养学生的分析、理解能力及化学实验、化学计算能力.

| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
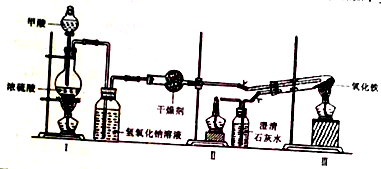
①按图连接好装置,检查装置气密性.
②称取0.2000gFe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲醇.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后停止加热,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲醇(HCOOH)在浓硫酸加热条件下的分解制得,写出该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O;
(2)实验步骤③应在检验CO纯度后,先点燃II(填“II”或“III”)处酒精灯;
(3)实验步骤⑤产物冷却至室温时应注意继续通入CO(或隔绝空气);
(4)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.利用能谱分析测出3种样品所含元素种类和各元素的质量分数如下表:分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种;
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过查资料获取如下信息:I.酒精灯平均温度为600℃,加网罩酒精灯平均温度为700℃,酒精灯平均温度为930℃.II.资料指出当反应温度高于710,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4,试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度;生成Fe的过程中发生的所有反应的化学方程式3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2,Fe3O4+CO$\frac{\underline{\;\;△\;\;}}{\;}$3FeO+CO2,Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
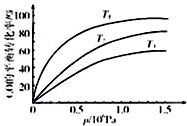
②达到平衡时CO的转化率为37.1%;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..