题目内容
1.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )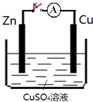
| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
分析 A.K打开,Zn与硫酸铜溶液发生置换反应;
B.无论K是否闭合,锌片均会溶解,铜离子都会转化为Cu;
C.原电池中阴离子向负极移动;
D.电子不能通过溶液.
解答 解:A.K打开,Zn与硫酸铜溶液发生置换反应,则在Zn片上有金属铜析出,故A正确;
B.无论K是否闭合,锌片均会溶解,铜离子都会转化为Cu,所以铜离子浓度减小,溶液均从蓝色逐渐变浅,故B正确;
C.原电池中阴离子向负极移动,则SO42-向锌电极移动,故C错误;
D.K闭合时,电子从负极Zn流向正极 Cu,但是电子不能通过溶液,溶液中离子移动,故D错误;
故选CD.
点评 本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
11.下列关于硅的化学性质的叙述,正确的是( )
| A. | 常温时不和任何酸反应 | B. | 常温时可和强碱溶液反应 | ||
| C. | 单质硅比碳的还原性弱 | D. | 单质硅比碳的氧化性强 |
12.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2 L SO3所含的原子数为2NA | |
| B. | 标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA | |
| C. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为NA |
9.下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
16.有关化学用语表达正确的是( )
| A. |  | |
| B. | C1-的结构示意图: | |
| C. | ${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd互为同位素 | |
| D. | 过氧化氢电子式: |
6.设NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
13.一定温度下,某一密闭恒容的容器内有可逆反应:A(g)+3B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
| A. | C物质的生成速率和A的生成速率相等 | |
| B. | 容器内气体的压强不再随时间而改变 | |
| C. | 单位时间内生成a mol物质A,同时生成3a mol物质B | |
| D. | A、B、C三种物质的分子数之比为1:3:2 |
10.钠和锂有相似的化学性质,下列说法中,能较好地解释这个事实的是( )
| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 最外层电子数相同 | D. | 化合价相同 |