题目内容
13.一定温度下,某一密闭恒容的容器内有可逆反应:A(g)+3B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )| A. | C物质的生成速率和A的生成速率相等 | |
| B. | 容器内气体的压强不再随时间而改变 | |
| C. | 单位时间内生成a mol物质A,同时生成3a mol物质B | |
| D. | A、B、C三种物质的分子数之比为1:3:2 |
分析 可逆反应A(g)+3B(g)?2C(g)为气体体积缩小的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.C物质的生成速率和A的生成速率相等,表示的是正逆反应速率,但是不满足计量数关系,说明没有达到平衡状态,故A错误;
B.该反应是气体体积缩小的反应,当容器内气体的压强不再随时间而改变时,正逆反应速率相等,各组分的浓度、百分含量不再变化,该反应达到平衡状态,故B正确;
C.单位时间内生成a mol物质A,同时生成3a mol物质B,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故C错误;
D.A、B、C三种物质的分子数之比为1:3:2,无法判断各组分的浓度是否发生变化,则无法判断平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡及其影响为解答关键,注意掌握化学平衡状态的特征及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
3.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | 使甲基橙呈红色的溶液:NO3-、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | pH=12的溶液:CO32-、Cl-、K+、F- |
4.微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液pH增大 | |
| B. | 在使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 | |
| D. | 外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
1.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
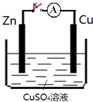

| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
8.下列叙述正确的是( )
| A. | 浓硫酸具有强氧化性,稀硫酸无氧化性 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸在常温下能够使铁、铝形成氧化膜而钝化 | |
| D. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
18.某元素X原子核外电子数等于核内中子数,取该元素单质2.8g与氧气充分作用,可得6g化合物XO2.该元素在周期表中的位置是( )
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
2.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
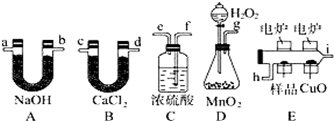 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.