题目内容
9.下列现象与氢键有关的是( )①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
分析 N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等.
①结构相似的分子,含有氢键的物质熔沸点较高,ⅤA族中,N的非金属性最强,氨气中分子之间存在氢键;
②小分子的醇、羧酸与水分子之间能形成氢键;
③,分子内氢键使溶沸点降低,分子间氢键使溶沸点升高,对羟基苯甲酸易形成分子之间氢键,邻羟基苯甲酸形成分子内氢键;
④稳定性与化学键有关;
⑤非金属性越强对应的氢化物越稳定.
解答 解:①因ⅤA族中,N的非金属性最强,氨气中分子之间存在氢键,氢键的存在导致物质的熔、沸点升高,则氨气的熔、沸点比ⅤA族其他元素氢化物的高,故①正确;
②因小分子的醇、羧酸与水分子之间能形成氢键,则小分子的醇、羧酸可以和水以任意比互溶,故②正确;
③邻羟基苯甲酸形成分子内氢键,使熔沸点偏低;对羟基苯甲酸分子间形成氢键,使熔沸点偏高,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故③正确;
④H-O键的键能较大,故H2O是一种非常稳定的化合物,与氢键无关,故④错误;
⑤非金属性越强,其氢化物越稳定,所以水分子较硫化氢分子稳定,与氢键无关,故⑤错误;
故选A.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.元素X与元素Y在周期表中位于相邻的两个周期,X与Y两原子核外电子数之和为19,Y原子核内质子数比X多3个.下列描述正确的是( )
| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式只能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类多 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
17.与下列装置相关的说法中不正确的是( )
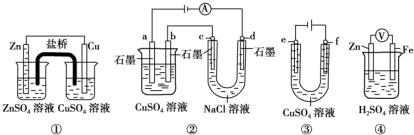

| A. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| B. | 装置②中b极析出6.4 g固体时,d极产生2.24 L H2 | |
| C. | 用装置③精炼铜时,f极为粗铜 | |
| D. | 装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
4.微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液pH增大 | |
| B. | 在使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 | |
| D. | 外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
14.某溶液中由水电离出来的C(H+)=10-12mol/L,则该溶液中能大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Na+、Cl- |
1.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
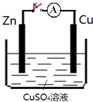

| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
18.某元素X原子核外电子数等于核内中子数,取该元素单质2.8g与氧气充分作用,可得6g化合物XO2.该元素在周期表中的位置是( )
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
19.下列化学用语或模型表示正确的是( )
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
 ;
;