题目内容
10.钠和锂有相似的化学性质,下列说法中,能较好地解释这个事实的是( )| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 最外层电子数相同 | D. | 化合价相同 |
分析 原子的结构决定元素的性质,当原子最外层电子数或价电子数相同时,元素性质相似,与元素的种类、半径以及化合价无关.
解答 解:A.金属元素有很多种,但性质不完全相似,只有位于同一主族的元素,性质才相似,故A错误;
B.同主族原子半径相差较大,但性质相似,同周期元素原子半径相差不大,但性质不同,故B错误;
C.Li和Na都位于周期表第Ⅰ主族,最外层电子数相同,性质相似,故C正确;
D.化合价相同的元素性质不一定相同,如Mg、Cu最高化合价都为+2价,但性质不同,故D错误.
故选C.
点评 本题考查原子结构与元素的性质,题目难度不大,本题注意把握原子结构决定性质的规律,当原子最外层电子数或价电子数相同时,元素性质相似.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
1.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
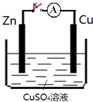

| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
18.某元素X原子核外电子数等于核内中子数,取该元素单质2.8g与氧气充分作用,可得6g化合物XO2.该元素在周期表中的位置是( )
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
15.NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2.对此反应,下列叙述正确的是( )
| A. | 使用催化剂能加快反应 | B. | 升高温度能增大反应的速率 | ||
| C. | 改变压强对反应速率没有影响 | D. | 降低温度能加快反应 |
2.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
19.下列化学用语或模型表示正确的是( )
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
 ;
; 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.