题目内容
12.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,11.2 L SO3所含的原子数为2NA | |
| B. | 标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA | |
| C. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为NA |
分析 A、标况下三氧化硫为固体;
B、分子个数N=$\frac{V}{{V}_{m}}{N}_{A}$;
C、过氧化氢分解为歧化反应,1mol过氧化氢分解转移1mol电子;
D、NO2和N2O4的摩尔质量不同.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、分子个数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA,故B正确;
C、过氧化氢分解为歧化反应,1mol过氧化氢分解转移1mol电子,故0.2mol过氧化氢分解转移0.2NA个电子,故C错误;
D、NO2和N2O4的摩尔质量不同,故46g混合物的物质的量无法计算,故分子个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在密闭容器中把CO和H2O的混合物加热到800℃,有下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),且平衡常数K=1.若在2L的密闭容器中充入1mol CO和1mol H2O相互混合并加热到800℃,则CO的转化率为( )
| A. | 40% | B. | 50% | C. | 60% | D. | 83.3% |
3.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | 使甲基橙呈红色的溶液:NO3-、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | pH=12的溶液:CO32-、Cl-、K+、F- |
17.与下列装置相关的说法中不正确的是( )
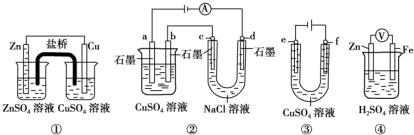

| A. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| B. | 装置②中b极析出6.4 g固体时,d极产生2.24 L H2 | |
| C. | 用装置③精炼铜时,f极为粗铜 | |
| D. | 装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
4.微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液pH增大 | |
| B. | 在使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 | |
| D. | 外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
1.某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
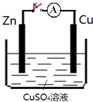

| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
2.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
 ;
; 某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )