题目内容
4. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序C<O<N;
(2)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量C与A形成的气体N,反应现象为先生成蓝色沉淀,当氨气过量时,沉淀溶解得到深蓝色溶液,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-;
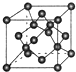
(3)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$.
分析 A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,则B是C元素;
D的原子核外有8个运动状态不同的电子,则D是O元素,C原子序数大于B而小于D,则C是N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子,E原子序数大于D,则E为Fe元素,F为Cu元素,以此解答该题.
解答 解:A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,则B是C元素;
D的原子核外有8个运动状态不同的电子,则D是O元素,C原子序数大于B而小于D,则C是N元素;
E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子,E原子序数大于D,则E为Fe元素,F为Cu元素,
(1)B、C、D分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以B、C、D第一电离能由低到高顺序是C<O<N,
故答案为:C<O<N;
(2)C与A形成的气体X,则A为H元素,X为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,可观察到先生成蓝色沉淀,当氨气过量时,沉淀溶解得到深蓝色溶液,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-,
故答案为:先生成蓝色沉淀,当氨气过量时,沉淀溶解得到深蓝色溶液;Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-;
(3)该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{12}{{N}_{A}}×8}{ρ}$cm3,该晶胞体长=$\sqrt{3}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$=$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,为高考常见题型,侧重于学生的分析能力和计算能力的考查,涉及核外电子排布、电负性、等电子体、晶体类型与性质、配合物、杂化理论、晶胞计算等,注意理解均摊法进行晶胞有关计算,难度中等.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案| A. | 1.6g臭氧中含有的氧原子数为0.1NA | |
| B. | 18gD2O中含有的质子数为10NA | |
| C. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2L己烷含有的分子数为0.5NA |
| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
| A. | NH4NO3 | B. | SiO2 | C. | C6H5NO2 | D. | Cu |
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]不溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+1 | |
| C. | 金元素在地壳中能以化合态的形式存在 | |
| D. | 在提炼过程中NaCN作氧化剂 |
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 1molAl3+含有核外电子数为10NA | |
| D. | 17gNH3含有的电子数为10NA |
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱(用化学方程式表达):Cl2+2NaBr=Br2+2NaCl.