题目内容
13.设NA表示阿伏加德罗常数的数值,下列说法中,不正确的是( )| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 1molAl3+含有核外电子数为10NA | |
| D. | 17gNH3含有的电子数为10NA |
分析 A、求出混合气体的物质的量,然后根据分子个数N=nNA来分析;
B、氦气为单原子分子;
C、铝离子含10个电子;
D、求出氨气的物质的量,然后根据氨气中含10个电子来分析.
解答 解:A、标况下22.4L混合气体的物质的量为1mol,故分子个数N=nNA=NA个,故A正确;
B、氦气为单原子分子,故1mol氦气中含NA个氦原子,故B错误;
C、铝离子含10个电子,故1mol铝离子的核外有10NA个电子,故C正确;
D、17g氨气的物质的量为1mol,而氨气中含10个电子,故1mol氨气中含10NA个电子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
3.下列化合物中,既含有离子键,又含有非极性共价键的是( )
| A. | H2O2 | B. | NaOH | C. | Na2O2 | D. | NH4Cl |
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式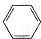 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型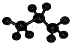 |
6.航天领域中常用N2H4与N2O4作为火箭发射的燃料与助燃剂.N2O4是一种无色气体,易分解:N2O4(g)?2NO2(g)-Q.N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4•H2O.t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
(1)前10min内用NO2表示的反应速率为0.04mol•L-1•min-1;该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
3.如表为元素周期表的一部分按要求完成各小题.
(1)化学性质最不活泼的元素Ar(填化学式,下同),非金属性最强的元素是F,金属性最强的单质与水反应的化学方程式为2K+2H2O=2KOH+H2↑
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: .
.