题目内容
15.如表为元素周期表的一部分,请回答有关问题:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱(用化学方程式表达):Cl2+2NaBr=Br2+2NaCl.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br元素,
(1)①和⑤分别是N、Si元素;
(2)元素周期表中,最活泼的金属元素位于周期表左下角、最活泼的非金属元素位于周期表右上角(稀有气体除外);
(3)Al元素能形成两性氢氧化物,⑥⑨最高价氧化物的水化物反应分别是H2SO4、KOH,Al(OH)3和强酸强碱反应都生成盐和水;
(4)卤素单质之间的置换反应可说明氧化性强弱.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br元素,
(1)⑤和⑧的元素符号是Si和 Ar,故答案为:Si;Ar;
(2)元素周期表中,最活泼的金属元素位于周期表左下角、最活泼的非金属元素位于周期表右上角(稀有气体除外),根据给予周期表结构知,最活泼的金属元素是K、最活泼的非金属元素是F元素,故答案为:K;F;
(3)Al元素能形成两性氢氧化物,⑥⑨最高价氧化物的水化物反应分别是H2SO4、KOH,Al(OH)3和强酸强碱反应都生成盐和水,其反应方程式分别为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O、Al(OH)3+KOH=KAlO2+2H2O,
故答案为:Al;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O;
(4)卤素单质之间的置换反应可说明氧化性的强弱,如Cl2+2NaBr=Br2+2NaCl,故答案为:Cl2+2NaBr=Br2+2NaCl.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意周期表的结构,题目难度不大.

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
| A. | 不一定是放热 | B. | 可燃物不一定是1mol | ||
| C. | 单位不一定是KJ | D. | 可燃物不一定是气体 |
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: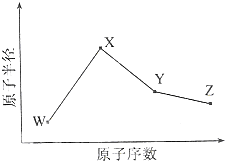 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.