题目内容
9.现有10g高锰酸钾,加热一段时间后剩余固体质量为9.2克,则产生的氧气质量是多少?高锰酸钾的分解率是多少?分析 反应前后固体减少的质量为生成氧气的质量,据此计算出生成氧气的质量;然后根据反应2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑计算出分解的高锰酸钾的质量,然后计算出高锰酸钾的分解率.
解答 解:设反应分解的KMnO4的质量为x,
反应前后固体减少的质量为生成氧气的质量,则反应产生O2的质量为:10g-9.2g=0.8g;
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
316 32
x 0.8g
则:$\frac{316}{x}$=$\frac{32}{0.8}$,
解得:x=7.9g,
则高锰酸钾的分解率为:$\frac{7.9g}{10g}$×100%=79%,
答:反应生成氧气的质量是0.8g,高锰酸钾的分解率是79%.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握分解率的概念及表达式,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
19.已知BF3分子的空间构型为平面三角形,用等电子原理判断,下列分子或离子的立体构型不是平面三角形的是( )
| A. | SO3 | B. | PCl3 | C. | NO3- | D. | BCl3 |
14.下列物质加入红墨水中,红墨水褪色的是( )
| A. | 氧化钠 | B. | 溴化钾 | C. | 次氯酸钙 | D. | 碘化钾 |
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式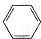 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型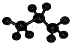 |
20.下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
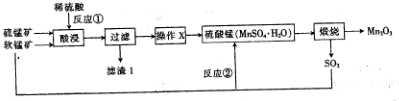
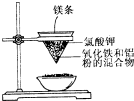 用如图所示的装置进行实验,回答下列问题:
用如图所示的装置进行实验,回答下列问题: 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: