题目内容
12.反应4A (s)+3B (g)?2C (g)+D (g),经2min,B的浓度减少0.6mol/L,对此下列说法不正确的是( )| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
分析 化学反应速率表示单位时间内浓度的变化量,固体或纯液体的浓度一般视为常数,一般也不用固体或纯液体来表示反应速,速率之比等于化学计量数之比为正反应速率之比;化学反应速率为一段时间内平均速率,不是即时速率,达到平衡后正逆反应速率相同.
解答 解:A.经2min,B的浓度减少0.6mol/L,则v(B)=0.6mol/L÷2min=0.3mol/(L•min),故A正确;
B.A是固体,浓度不变,所以不能表示化学反应速率,故B错误;
C.速率之比等于化学计量数之比,故v(C)=2/3 v(B)=2/3×0.3mol/(L•min)=0.2mol/(L•min),故C正确;
D.在任何时刻都存在V正(B)=3V正(D),若V正(B)=3V逆(D),则V正(D)=V逆(D),反应达到平衡状态,故D正确,
故选B.
点评 本题考查化学速率的有关计算,题目难度中等.要注意反应速率之比为正反应速率之比,当正逆反应速率相同时反应达到平衡状态.

练习册系列答案
相关题目
3.下列化合物中,既含有离子键,又含有非极性共价键的是( )
| A. | H2O2 | B. | NaOH | C. | Na2O2 | D. | NH4Cl |
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式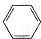 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型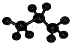 |
3.如表为元素周期表的一部分按要求完成各小题.
(1)化学性质最不活泼的元素Ar(填化学式,下同),非金属性最强的元素是F,金属性最强的单质与水反应的化学方程式为2K+2H2O=2KOH+H2↑
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
 X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,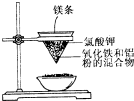 用如图所示的装置进行实验,回答下列问题:
用如图所示的装置进行实验,回答下列问题: 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: