题目内容
14.二氧化硫为无色气体,有强烈刺激性气味,是大气主要污染物之一.某化学兴趣小组欲制备并探究SO2的某些性质.【SO2的制备】用亚硫酸钠与较浓的硫酸反应制备SO2的装置图如图1(夹持仪器省略):
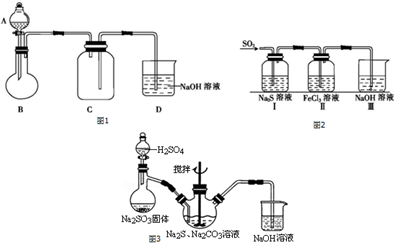
(1)图中的装置错误的是集气瓶C中导管长短反了;B中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;D的作用是吸收尾气中的SO2,防止污染环境.
【SO2的性质】探究SO2气体性质的装置如图2所示:
(2)装置Ⅰ中的现象是有浅黄色沉淀生成,写出装置Ⅰ中通入足量SO2的离子方程式2S2-+5SO2+2H2O=3S↓+4HSO3-.
(3)在上述装置中通入过量的SO2,为了验证Ⅱ中发生了氧化还原反应,取Ⅱ中溶液分成两份,
并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案不合理的方案是方案一,原因是过量的二氧化硫能溶于水,也能使高锰酸钾褪色,写出解释该原因的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)SO2可以用来制备硫代硫酸钠,硫代硫酸钠可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3.写出如图3所示装置中三颈瓶中由反应制取Na2S2O3的化学方程式2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 .
分析 (1)根据图1装置可知,二氧化硫密度大于空气,所以收集二氧化硫时应长时短出,B中发生反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,二氧化硫会污染空气,所以要进行尾气吸收;
(2)二氧化硫通入硫化钠溶液发生氧化还原反应生成淡黄色沉淀硫单质,说明二氧化硫具有氧化性,氧化硫离子生成硫单质,足量二氧化硫和硫化钠溶液反应得到硫单质和亚硫酸氢钠;
(3)过量的二氧化硫能溶于水,也能使高锰酸钾褪色,据此判断;
(4)实验室可通过Na2S、Na2CO3和SO2共同反应生成二氧化碳和Na2S2O3.
解答 解:(1)根据图1装置可知,二氧化硫密度大于空气,所以收集二氧化硫时应长时短出,所以C处有错,装置B中发生的反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;二氧化硫会污染空气,所以D的作用是进行尾气吸收,
故答案为:集气瓶C中导管长短反了;Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;吸收尾气中的SO2,防止污染环境;
(2)二氧化硫通入硫化钠溶液发生氧化还原反应生成淡黄色沉淀硫单质;足量二氧化硫和硫化钠溶液反应得到硫单质和亚硫酸氢钠,反应的离子方程式为:2S2-+5SO2+2H2O=3S↓+4HSO3-,
故答案为:有浅黄色沉淀生成;2S2-+5SO2+2H2O=3S↓+4HSO3-;
(3)过量的二氧化硫能溶于水,也能使高锰酸钾褪色,所以方案一不合理,反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:方案一;过量的二氧化硫能溶于水,也能使高锰酸钾褪色; 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)实验室可通过Na2S、Na2CO3和SO2共同反应生成二氧化碳和Na2S2O3,反应的化学方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 ,
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 .
点评 本题考查了物质制备、性质方案的设计,题目难度中等,涉及了二氧化硫性质、离子方程式书写、实验方案的设计与评价等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | K>Na | B. | 金刚石>SiO2 | C. | SiH4>CH4 | D. | KCl>NaCl |
| A. | 元素的最高正化合价在数值上一定等于它所在的族序数 | |
| B. | 同周期主族元素的原子半径越小,越难得到电子 | |
| C. | 氟气能从溴化钾溶液中置换出溴单质 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
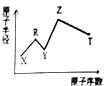 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 与同主族元素的氢化物相比较,R和Y的氢化物最稳定 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性 |
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ.mol-1、285.8kJ.mol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电 池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW.h.kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).

 .
.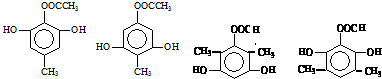 任意一种.
任意一种.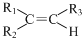 $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 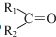 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以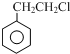 为原料制备
为原料制备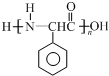 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).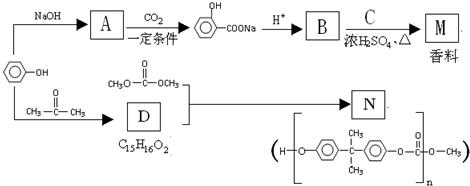
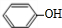 +NaOH→
+NaOH→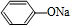 +H2O.
+H2O. ;
;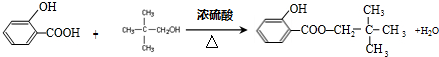 .
.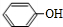 +
+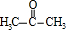 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$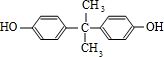 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应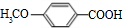 .
.