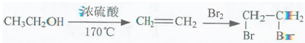题目内容
5.下列有关元素或物质性质的说法正确的是( )| A. | 元素的最高正化合价在数值上一定等于它所在的族序数 | |
| B. | 同周期主族元素的原子半径越小,越难得到电子 | |
| C. | 氟气能从溴化钾溶液中置换出溴单质 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
分析 A.氟元素没有正化合价;
B、同周期的元素,从左向右原子半径在减小,金属性减弱;
C、氟与水反应生成氢氟酸和氧气;
D、元素的非金属性越强,它的最高价氧化物的水化物酸性越强.
解答 解:A.氟元素没有正化合价,过渡元素的最高正化合价可能高于其周期数,故A错误;
C、同周期的元素,从左向右原子半径在减小,金属性性减弱,则同周期的元素的原子半径越小,越难失去电子,故B错误;
C、氟与水反应生成氢氟酸和氧气,而不是与溴发生置换反应,故C错误;
D、元素的非金属性越强,它的最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期原子结构与元素周期律的关系是解本题关键,注意规律中的反常现象.

练习册系列答案
相关题目
16.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
| A. | 已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 | |
| B. | 已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强 | |
| C. | 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 | |
| D. | 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大 |
13.实验室用100mL 1mol•L-1盐酸与足量锌粉反应制备氢气,下列措施能加快反应速率且不影响产生氢气的量是( )
| A. | 改用100mL2mol•L-1盐酸 | B. | 加入碳酸钠固体 | ||
| C. | 滴加少量CuCl2溶液 | D. | 降低温度 |
20.下列互为同位素的是( )
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |
17.下列有关有机化合物的叙述正确的是( )
| A. | 植物油与聚乙烯均能使溴水褪色 | |
| B. | 淀粉与纤维素均为高分子化合物且互为同分异构体 | |
| C. | 蔗糖与麦芽糖的水解产物均为葡萄糖 | |
| D. | 丙烷与2-甲基丙烷的一氯代物均为两种 |
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
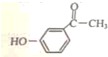 .
.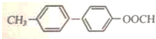 .
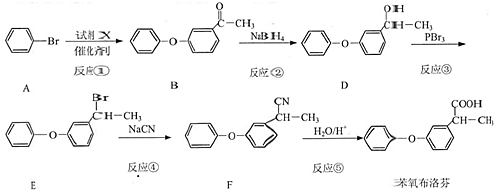
.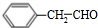 为原料制备
为原料制备 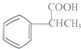 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: