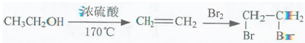题目内容
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
分析 A、HS-在溶液中既能水解为H2S又能电离为S2-;
B、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、铁与水蒸汽反应后变为+$\frac{8}{3}$价.
解答 解:A、HS-在溶液中既能水解为H2S又能电离为S2-,根据物料守恒可知溶液中H2S、HS-和S2-的个数之和为0.1NA个,故A错误;
B、H218O与D2O的摩尔质量均为20g/mol,且均含10个中子,故2.0g混合物的物质的量为0.1mol,含NA个中子,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3NA个离子,故C错误;
D、铁与水蒸汽反应后变为+$\frac{8}{3}$价,故3mol铁和水蒸汽反应后转移8mol电子即8NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
13.实验室用100mL 1mol•L-1盐酸与足量锌粉反应制备氢气,下列措施能加快反应速率且不影响产生氢气的量是( )
| A. | 改用100mL2mol•L-1盐酸 | B. | 加入碳酸钠固体 | ||
| C. | 滴加少量CuCl2溶液 | D. | 降低温度 |
11.下列过程中涉及化学反应的是( )
| A. | 通过“扫描隧道显微镜”操纵原子“书写”文字 | |
| B. | 14C考古断代 | |
| C. | 煤焦油分馏得到苯及其同系物 | |
| D. | 粮食酿酒 |
18.室温下,0.1mol下列物质分别与1L0.1mol/LNaOH溶液反应,所得溶液pH最小的是( )
| A. | SO3 | B. | NO2 | C. | Al2O3 | D. | SO2 |
8.下列除杂(括号内为少量杂质)操作正确的是( )
| 物质(少量杂质) | 操作 | |
| A | KNO3固体(NaCl) | 加水溶解、蒸发结晶、趁热过滤、洗涤、干燥 |
| B | NaCl固体(KNO3) | 加水溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
| C | FeCl3溶液(NH4Cl) | 加热蒸干、灼烧 |
| D | NH4Cl溶液(FeCl3) | 滴加氨水至不再产生沉淀为止,过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 用米汤检验碘盐中的碘 | |
| B. | 用热的烧碱溶液洗涤餐具上的油污 | |
| C. | “地沟油”禁止食用,但可用来制取肥皂 | |
| D. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 |
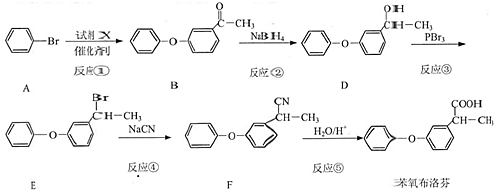
 .
.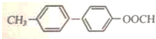 .
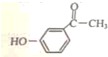
.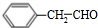 为原料制备
为原料制备 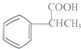 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: