题目内容
4.下列各物质的熔点比较正确的是( )| A. | K>Na | B. | 金刚石>SiO2 | C. | SiH4>CH4 | D. | KCl>NaCl |
分析 A、金属晶体中原子半径越小,电荷越大,熔点越高;
B、原子晶体中半径越小,共价键越强,熔点越高;
C、分子晶体中相对分子质量越大,熔点越高,含有氢键的熔点较高;
D、离子晶体中阴阳离子半径和越小,电荷越大,熔点越高.
解答 解:A、K、Na都是金属晶体,原子半径顺序:Na<K,金属晶体中原子半径越小,电荷越大,熔点越大,所以熔点顺序:Na>K,故A错误;
B、金刚石、SiO2都是原子晶体,因键长C-C<O-Si,原子晶体中半径越小,共价键越强,熔点越大,则熔点为金刚石大于二氧化硅,故B正确;
C、SiH4、CH4都是分子晶体,分子晶体中相对分子质量越大,熔点越大,所以熔点SiH4>CH4,故C正确;
D、NaCl、KCl都是离子晶体,阴阳离子半径和大小顺序:NaCl<KCl,离子晶体中阴阳离子半径和越小,电荷越大,熔点越大;所以熔点高低顺序为:NaCl>KCl,故D错误;
故选BC.
点评 本题考查晶体熔点的比较,明确不同类型晶体熔点的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
14.下列叙述不正确的是( )
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
12.下列离子在pH=1的溶液中能大量存在的是( )
| A. | HCO3- | B. | AlO2- | C. | SO32- | D. | Mg2+ |
16.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
| A. | 已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 | |
| B. | 已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强 | |
| C. | 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 | |
| D. | 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大 |
13.实验室用100mL 1mol•L-1盐酸与足量锌粉反应制备氢气,下列措施能加快反应速率且不影响产生氢气的量是( )
| A. | 改用100mL2mol•L-1盐酸 | B. | 加入碳酸钠固体 | ||
| C. | 滴加少量CuCl2溶液 | D. | 降低温度 |
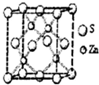 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答: ③白磷 ④氯气
③白磷 ④氯气 ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷
⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷 ,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.
,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.