题目内容
 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:(1)下列措施中,符合“低碳”经济理念的有
a.采用节能技术.减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导节能生活
c.利用太阳能、风能等新型能源替代化石燃料
d.各地为促进经济发展,新建一批小型火电厂.
(2)煤的汽化和液化可以提高燃料的利用率.
已知25℃时101kPa时:C(s)+
| 1 |
| 2O2(g) |
2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ.mol-1
H2O(g)=H2O(l);△H=-44kJ.mol-1
在25℃时101kPa时:C(s)+H2O(g)=CO(g)+H2(g);△H=
(3)将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O
(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应为
(取小数二位).
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min则a、b应满足的关系是
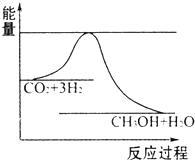
(4)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)如图表示该反应进行过程中能量(单位为kJ.mol-1的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3OH)增大的是
a.升高温度b.充入He(g),使体系压强增大c.将H2O(g)从体系中分离出来d.再充入1molCO2和3molH2
(5)利用甲醇设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,采用铂或碳化钨作为电极催化剂.则通入氧气的电极应为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学电源新型电池,使用化石燃料的利弊及新能源的开发
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)低碳经济以低能耗、低排放、低污染为基础,其实质是提高能源利用效率和创建清洁能源结构,据此回答;
(2)依据盖斯定律解答,从所求反应出发,分析反应物生成物的位置,通过加减可得;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=
计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
③反应前后气体体积不变,实验2相似的平衡状态(即各物质的质量分数分别相等),为等效平衡,满足CO(g)与H2O(g)的物质的量为1:2,由于到达平衡时间t<3min,物质的量应比实验2大或使用催化剂;
(4)根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动;
(5)用氢氧化钾溶液作电解质溶液,甲醇在负极上失去电子生成碳酸根离子和水,氧气在正极上得到电子生成氢氧根离子,阳离子移向正极.
(2)依据盖斯定律解答,从所求反应出发,分析反应物生成物的位置,通过加减可得;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=
| ||
| △t |
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
③反应前后气体体积不变,实验2相似的平衡状态(即各物质的质量分数分别相等),为等效平衡,满足CO(g)与H2O(g)的物质的量为1:2,由于到达平衡时间t<3min,物质的量应比实验2大或使用催化剂;
(4)根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动;
(5)用氢氧化钾溶液作电解质溶液,甲醇在负极上失去电子生成碳酸根离子和水,氧气在正极上得到电子生成氢氧根离子,阳离子移向正极.
解答:
解:(1)a.采用节能技术,减少化石燃料的用量,可减少二氧化碳的排放,符合“低碳”经济理念,故正确;
b.鼓励乘坐公交车出行,倡导节能生活,可减少二氧化碳的排放,符合“低碳”经济理念,故正确;
c.太阳能、风能等新型能源不能替代化石燃料,故错误;
d.新建一批小型火电厂,不会减少二氧化碳的排放,不符合“低碳”经济理念,故错误;
故选ab;
(2)已知
①C(s)+
O2(g)═CO(g)△H=-126.4kJ?mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
③H2O(g)═H2O(l)△H=-44kJ?mol-1
据盖斯定律,①-②×
+③得:C(s)+H2O(g)═CO(g)+H2(g)△H=(-126.4kJ?mol-1)-(-571.6kJ?mol-1)×
+(-44kJ?mol-1)=+115.4KJ/mol
故答案为:+115.4KJ/mol;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=
≈0.13mol/(L?min),速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.16mol/(L?min)=0.13mol/(L?min),
故答案为:0.13mol/(L?min);
②实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,逆反应是吸热反应;实验2条件下,CO的物质的量变化量为4mol-2.4mol=1.6mol,所以CO2、H2的物质的量变化量为1.6mol,平衡常数K=
≈0.17,
故答案为:吸;0.17;
③反应前后气体体积不变,实验2相似的平衡状态(即各物质的质量分数分别相等),为等效平衡,满足CO(g)与H2O(g)的物质的量为1:2,即a:b=1:2,b=2a,由于到达平衡时间t<3min,所以速率较实验2快,故a>0.5(或使用催化剂).
故答案为:b=2a,a>0.5(或使用催化剂).
(4)a.升高温度,平衡逆向移动,c(CH3OH)减小,故a错误;
b.充入He(g),使体系压强增大,由于容器为恒容容器,各组分浓度不变,平衡不移动,c(CH3OH)不变,故b错误;
c.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,故c正确;
d.再充入1mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,故d正确.
故答案为:cd;
(5)用氢氧化钾溶液作电解质溶液,甲醇在负极上失去电子生成碳酸根离子和水,负极反应为CH3OH-6e-+8 OH-═CO32-+6H2O,氧气在正极上得到电子生成氢氧根离子,通入氧气的电极应为正极,阳离子钾离子移向正极,故答案为:正;正.
b.鼓励乘坐公交车出行,倡导节能生活,可减少二氧化碳的排放,符合“低碳”经济理念,故正确;
c.太阳能、风能等新型能源不能替代化石燃料,故错误;
d.新建一批小型火电厂,不会减少二氧化碳的排放,不符合“低碳”经济理念,故错误;
故选ab;
(2)已知
①C(s)+
| 1 |
| 2 |
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1
③H2O(g)═H2O(l)△H=-44kJ?mol-1
据盖斯定律,①-②×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+115.4KJ/mol;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=
| ||
| △t |
| ||
| 6 |
故答案为:0.13mol/(L?min);
②实验1中CO的转化率为
| 4-2.4 |
| 4 |
| 2-1.6 |
| 2 |
| ||||
|
故答案为:吸;0.17;
③反应前后气体体积不变,实验2相似的平衡状态(即各物质的质量分数分别相等),为等效平衡,满足CO(g)与H2O(g)的物质的量为1:2,即a:b=1:2,b=2a,由于到达平衡时间t<3min,所以速率较实验2快,故a>0.5(或使用催化剂).
故答案为:b=2a,a>0.5(或使用催化剂).
(4)a.升高温度,平衡逆向移动,c(CH3OH)减小,故a错误;
b.充入He(g),使体系压强增大,由于容器为恒容容器,各组分浓度不变,平衡不移动,c(CH3OH)不变,故b错误;
c.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,故c正确;
d.再充入1mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,故d正确.
故答案为:cd;
(5)用氢氧化钾溶液作电解质溶液,甲醇在负极上失去电子生成碳酸根离子和水,负极反应为CH3OH-6e-+8 OH-═CO32-+6H2O,氧气在正极上得到电子生成氢氧根离子,通入氧气的电极应为正极,阳离子钾离子移向正极,故答案为:正;正.
点评:本题考查反应速率、平衡常数、化学平衡以及热化学和电化学的有关计算应用,难度中等,注意对知识的理解与掌握,是对学生能力的考查.

练习册系列答案
相关题目
30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )
| A、c(H+)?c(OH-)>1×10-14 |
| B、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
水溶液中能大量共存的一组离子是( )
| A、Na+、Ca2+、Cl-、SO42- |
| B、Mg2+、NH4+、Cl-、SO42- |
| C、Fe2+、H+、SO32-、ClO- |
| D、K+、Fe3+、NO3-、SCN- |
下列物质熔点比较错误的( )
| A、Na<Mg<Al |
| B、Br2<Cl2<I2 |
| C、硅<碳化硅<金刚石 |
| D、AlCl3<KCl<NaCl |
在一密闭容器中加入一定物质的量的A气体,发生 a A(g)?b B(g)+c C(g)反应,达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时c(A)变为原平衡的40%,下列说法正确的是( )
| A、化学计量数之间的关系:a>b+c |
| B、物质B的体积分数减小 |
| C、平衡向正反应方向移动 |
| D、平衡移动过程中,与原平衡相比v正增大、v逆减小 |
下列说法正确的是( )
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
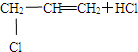 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |


