题目内容
在一密闭容器中加入一定物质的量的A气体,发生 a A(g)?b B(g)+c C(g)反应,达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时c(A)变为原平衡的40%,下列说法正确的是( )
| A、化学计量数之间的关系:a>b+c |
| B、物质B的体积分数减小 |
| C、平衡向正反应方向移动 |
| D、平衡移动过程中,与原平衡相比v正增大、v逆减小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:保持温度不变,将容器体积扩大了一倍,当达到新的平衡时c(A)变为原平衡的40%,若平衡不移动,平衡时c(A)应变为原平衡的50%,说明平衡应该向正反应方向移动,即a<b+c,据此解答.
解答:
解:保持温度不变,将容器体积扩大了一倍,当达到新的平衡时c(A)变为原平衡的40%,若平衡不移动,平衡时c(A)应变为原平衡的50%,说明平衡应该向正反应方向移动,即a<b+c,
A.由上述分析可知,减小压强平衡向正反应移动,a<b+c,故A错误;
B.平衡向正反应方向移动,B的体积分数增大,故B错误;
C.平衡向正反应移动,故C正确;
D.体积增大,压强减小,正逆反应速率减小,故D错误.
故选C.
A.由上述分析可知,减小压强平衡向正反应移动,a<b+c,故A错误;
B.平衡向正反应方向移动,B的体积分数增大,故B错误;
C.平衡向正反应移动,故C正确;
D.体积增大,压强减小,正逆反应速率减小,故D错误.
故选C.
点评:本题考查化学平衡计算及化学平衡移动,明确体积变化引起A的浓度变化是解答本题的关键,注意动态变化与静态变化相结合得出平衡正向移动即可解答,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是( )
| A、萃取 | B、蒸馏 |
| C、过滤 | D、丁达尔效应 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法正确的是( )
| 130℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A、5NH4NO3
| ||||
| B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
| D、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
下列各组离子一定能大量共存的是( )
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题: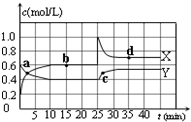 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.