题目内容
下列说法正确的是( )
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
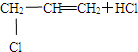 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |
考点:有机化学反应的综合应用
专题:有机反应
分析:A、1mol甲烷中有4molH,每molH原子与1mol氯原子取代,需要1mol氯气;
B、酯类水解原理是断开酯基,分别连接羟基与H原子;
C、加成反应是不饱和键断开结合原子或者原子团变成不饱和键;
D、甲苯的硝化反应是取代反应,由于甲基的存在导致苯环上甲基邻位与对位变得较活泼,但是甲基不变.
B、酯类水解原理是断开酯基,分别连接羟基与H原子;
C、加成反应是不饱和键断开结合原子或者原子团变成不饱和键;
D、甲苯的硝化反应是取代反应,由于甲基的存在导致苯环上甲基邻位与对位变得较活泼,但是甲基不变.
解答:
解:A、1mol甲烷中有4molH,每1molH原子与1mol氯原子取代,需要1mol氯气,故故1molCH4与Cl2发生取代反应最多消耗4molCl2,故A错误;
B、酯类水解原理是断开酯基,分别连接羟基与H原子,属于取代反应,故B正确;
C、加成反应是不饱和键断开结合原子或者原子团变成不饱和键,此反应为取代反应,故C错误;
D、甲苯的硝化反应是取代反应,由于甲基的存在导致苯环上甲基邻位与对位变得较活泼,但是甲基不变,故D错误,故选B.
B、酯类水解原理是断开酯基,分别连接羟基与H原子,属于取代反应,故B正确;
C、加成反应是不饱和键断开结合原子或者原子团变成不饱和键,此反应为取代反应,故C错误;
D、甲苯的硝化反应是取代反应,由于甲基的存在导致苯环上甲基邻位与对位变得较活泼,但是甲基不变,故D错误,故选B.
点评:本题主要考查的是烷烃的取代反应,加成反应定义、酯类水解原理,综合性较强,但是难度不大.

练习册系列答案
相关题目
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A、5NH4NO3
| ||||
| B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
| D、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol-CH3和1 mol OH-都含有10 NA个电子 |
| B、常温常压下,8gCH4含有2NA个共价键 |
| C、1L 0.1 mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下22.4 L 乙醇含碳原子数为NA |
将Cl2通入NaOH溶液中,反应得到NaCl,NaClO3,NaClO的混合溶液,其中ClO-、ClO3-的浓度比为1:3,则Cl2与NaOH反应时,被还原的氯元素和被氧化的氯元素的物质的量的比是( )
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
有一包铁粉和铜粉混合物均匀的粉末样品,为了确定其组成,某同学将不同质量的该样品分别与40mL1mol?L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
下列各组离子一定能大量共存的是( )
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
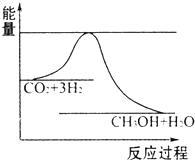 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题: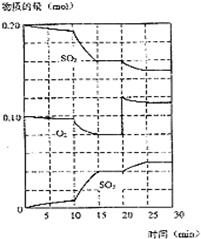 已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:
已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应: