题目内容
不锈钢中有一种重要的金属元素铬,是由铬铁矿(FeCr2O4)提炼而来,工业上用如下工艺将铬铁矿制得较纯的铬:

已知:CrO42-
Cr2O72-
(1)写出铬铁矿煅烧的化学方程式 .
(2)请写出操作①的内容 ;实验室中进行操作②所需的玻璃仪器是 .
(3)酸化过程中所用酸不宜选用 (填序号).
a.硫酸 b.硝酸 c.盐酸
(4)为控制生产过程中的pH,实验室用0.01mol?L-1NaOH溶液测定所用酸的浓度:

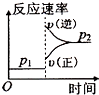
图中 图是可能的滴定过程示意图,滴定时用酚酞作指示剂,当 ,即判定到达滴定终点.
(5)滴定时取酸液10mL稀释至1L,取5mL进行滴定,直至终点.计算所用酸的c(H+)= .
(6)请在图中将具体滴定过程描成实线.

已知:CrO42-
| ||
(1)写出铬铁矿煅烧的化学方程式
(2)请写出操作①的内容
(3)酸化过程中所用酸不宜选用
a.硫酸 b.硝酸 c.盐酸
(4)为控制生产过程中的pH,实验室用0.01mol?L-1NaOH溶液测定所用酸的浓度:

图中
(5)滴定时取酸液10mL稀释至1L,取5mL进行滴定,直至终点.计算所用酸的c(H+)=
(6)请在图中将具体滴定过程描成实线.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铬铁矿(FeCr2O4)与Na2CO3混合,高温煅烧,被氧化为Fe2O3和Na2CrO4,配成溶液,过滤掉不溶的Fe2O3,向Na2CrO4溶液加酸,调节PH值,结晶得到NaCr2O7,高温下NaCr2O7被C还原为Cr2O3,经过过滤不溶性的氧化铁提纯,铝热反应制得较纯的铬,
(1)铬铁矿与碳酸钠混合煅烧生成氧化铁、铬酸钠与二氧化碳气体;
(2)酸性条件下,铬酸钠浓缩结晶得到张铬酸钠晶体,过滤使用烧杯、玻棒、漏斗;
(3)CrO42-转化的Cr2O72-中Cr是+6价,具有强氧化性,不能使用还原性的酸;
(4)经过酸化后,溶液呈酸性,PH较小,加入氢氧化钠后,PH逐渐增大;
(5)根据酸碱中和计算;
(6)图象Ⅰ符合实际情况.
(1)铬铁矿与碳酸钠混合煅烧生成氧化铁、铬酸钠与二氧化碳气体;
(2)酸性条件下,铬酸钠浓缩结晶得到张铬酸钠晶体,过滤使用烧杯、玻棒、漏斗;
(3)CrO42-转化的Cr2O72-中Cr是+6价,具有强氧化性,不能使用还原性的酸;
(4)经过酸化后,溶液呈酸性,PH较小,加入氢氧化钠后,PH逐渐增大;
(5)根据酸碱中和计算;
(6)图象Ⅰ符合实际情况.
解答:
解:铬铁矿(FeCr2O4)与Na2CO3混合,高温煅烧,被氧化为Fe2O3和Na2CrO4,配成溶液,过滤掉不溶的Fe2O3,向Na2CrO4溶液加酸,调节PH值,结晶得到NaCr2O7,高温下NaCr2O7被C还原为Cr2O3,经过滤不溶性的氧化铁提纯,铝热反应制得较纯的铬,
(1)铬铁矿煅烧生成铬酸钠,反应化学方程式为4FeCr2O4+8Na2CO3+7O2
2Fe2O3+8Na2CrO4+8CO2,故答案为:4FeCr2O4+8Na2CO3+7O2
2Fe2O3+8Na2CrO4+8CO2;
(2)酸性条件下,铬酸钠浓缩结晶得到张铬酸钠晶体,过滤使用烧杯、玻棒、漏斗,故答案为:浓缩、结晶;烧杯、玻棒、漏斗;
(3)CrO42-转化的Cr2O72-中Cr是+6价,具有强氧化性,不能使用还原性的酸,不能使用盐酸,故答案为:c;
(4)经过酸化后,溶液呈酸性,PH较小,加入氢氧化钠后,PH逐渐增大,图Ⅰ符合,滴定时用酚酞作指示剂,若溶液由无色变为粉红色且半分钟内不褪色,则说明达到滴定终点,故答案为:I;溶液由无色变为粉红色且半分钟内不褪色;
(5)0.01mol?L-1NaOH溶液共用20mL,滴定时取酸液10mL稀释至1L,取5mL进行滴定,直至终点,则
×5=0.01×20,解得c=4.0mol/L,故答案为:4.0mol/L;
(6)图象Ⅰ符合实际情况,描成实线为 ,故答案为:
,故答案为: .
.
(1)铬铁矿煅烧生成铬酸钠,反应化学方程式为4FeCr2O4+8Na2CO3+7O2
| ||
| ||
(2)酸性条件下,铬酸钠浓缩结晶得到张铬酸钠晶体,过滤使用烧杯、玻棒、漏斗,故答案为:浓缩、结晶;烧杯、玻棒、漏斗;
(3)CrO42-转化的Cr2O72-中Cr是+6价,具有强氧化性,不能使用还原性的酸,不能使用盐酸,故答案为:c;
(4)经过酸化后,溶液呈酸性,PH较小,加入氢氧化钠后,PH逐渐增大,图Ⅰ符合,滴定时用酚酞作指示剂,若溶液由无色变为粉红色且半分钟内不褪色,则说明达到滴定终点,故答案为:I;溶液由无色变为粉红色且半分钟内不褪色;
(5)0.01mol?L-1NaOH溶液共用20mL,滴定时取酸液10mL稀释至1L,取5mL进行滴定,直至终点,则
| c |
| 100 |
(6)图象Ⅰ符合实际情况,描成实线为
 ,故答案为:
,故答案为: .
.
点评:本题考查混合物的分离、提纯,明确流程中操作的目的是解答的关键,注意利用关系式计算,题目难度中等.

练习册系列答案
相关题目
对2Na2O2+2CO2═2Na2CO3+O2下列说法正确的是( )
| A、是氧化还原反应,Na2O2是氧化剂,CO2是还原剂 |
| B、是氧化还原反应,CO2是氧化剂,Na2O2是还原剂 |
| C、不是氧化还原反应,是碱性氧化和酸性氧化物反应 |
| D、是氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
某同学实际配制的NaOH溶液的浓度偏低,其原因不正确的是( )
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
9.2g金属钠投入到足量的重水(2H216O)中,则产生的气体中含有( )
| A、0.2 mol中子 |
| B、0.4 mol电子 |
| C、0.2 mol质子 |
| D、0.4 mol分子 |
配制一定物质的量浓度溶液时,下列操作会使配得溶液物质的量浓度偏高的是( )
| A、没有洗涤烧杯和玻璃棒 |
| B、定容时凹液面最低点低于刻度线 |
| C、容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液 |
| D、转移过程中有少量溶液溅出 |
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |




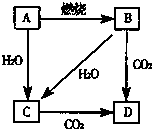 如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:
如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式: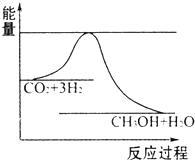 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题: