题目内容
30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )
| A、c(H+)?c(OH-)>1×10-14 |
| B、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:30℃时,水的离子积常数大于1×10-14,Na2S、NaHS都发生水解,溶液呈碱性,且Na2S水解程度大于NaHS,两溶液中都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-);Na2S、NaHS的组成不同,则两溶液中的物料守恒、质子守恒不同,据此进行解答.
解答:
解:A.常温时,c(H+)?c(OH-)=1×10-14,温度升高促进水的电离,则30℃时,c(H+)?c(OH-)>1×10-14,故A正确;
B.根据物料守恒:在0.1mol?L-1的Na2S溶液中存在:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S),故B错误;
C.根据质子守恒:在0.1mol?L-1的Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(OH-)=c(H+)+c(H2S),故C错误;
D.从溶液呈电中性的角度分析,两溶液中均存在:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故D正确;
故选AD.
B.根据物料守恒:在0.1mol?L-1的Na2S溶液中存在:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S),故B错误;
C.根据质子守恒:在0.1mol?L-1的Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S),在0.1mol?L-1的NaHS溶液中存在:c(OH-)=c(H+)+c(H2S),故C错误;
D.从溶液呈电中性的角度分析,两溶液中均存在:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故D正确;
故选AD.
点评:本题考查离子浓度的大小比较,题目难度中等,注意掌握盐的水解原理,明确水的离子积及其影响因素,把握物料守恒和质子守恒的运用方法.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、无色溶液中:K+、Fe3+、SO42-、SCN- | ||
C、
| ||
| D、由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
下列说法正确的是( )
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C、“绿色化学”的核心是利用化学原理进行环境治理 |
| D、生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
生活中下列物质的应用或现象解释错误的是( )
| A、食盐可作调味剂,也可作食品防腐剂 |
| B、大量燃烧化石燃料是造成雾霾天气的重要因素之一 |
| C、装饰材料释放的甲醛会造成空气污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |




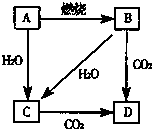 如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:
如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式: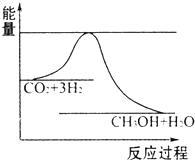 国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题:
国务院总理温家宝在哥本哈根世界气候峰会上表示,中国正处于工业化、城镇化快速发展的关键阶段,能源结构以煤为主,降低排放存在特殊困难,但仍始终把应对气候变化作为重要战略任务.现在“低碳循环”已经引起了国民的重视,试回答下列问题: