题目内容
16.下列说法正确的是( )| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 | |
| D. | 洗涤油污常用热的碳酸钠溶液 |
分析 A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,硫酸铝水解生成氢氧化铝和硫酸,当溶液蒸干时,得到的固体是硫酸铝;
B.加入盐酸,引入杂质;
C.碳酸钠溶液呈碱性;
D.油脂在碱性条件下可水解.
解答 解:A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解生成氧化铝和水蒸气,所以得到的固体为Al2O3,硫酸铝水解生成氢氧化铝和硫酸,加热促进硫酸铝水解,因为硫酸没有挥发性,所以得到的固体仍然是Al2(SO4)3,故A错误;
B.加入盐酸,引入杂质,应加入硫酸酸化,故B错误;
C.碳酸钠溶液呈碱性,易导致玻璃塞打不开,故C错误;
D.碳酸钠溶液呈碱性,油脂在碱性条件下可水解,故D正确;
故选D.
点评 本题考查了盐类水解、该考点是高考考查的重点和热点,本题比较贴近生活,有利用激发学生学习化学的兴趣,该题难度适中.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
6.碳、氮及其化合物在生产中有重要应用.
(1)设反应 ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如表:
现有反应 ③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3
结合表数据,根据反应①、②推导出推导出Q1、Q2、Q3的关系式Q3=Q1-Q2,反应③是吸热(填“放”或“吸”)热反应.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,其中两个反应为:
Ⅰ.CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)
Ⅱ.CH4(g)+2NO2(g) $\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)
实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应Ⅱ,测得在不同温度、不同投料比时,NO2的平衡转化率如表:
①写出该反应平衡常数的表达式K=$\frac{c({N}_{2})•c(C{O}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$,若降低温度,提高[n(NO2)/n(CH4)]
投料比,则K将增大.(填“增大”、“减小”或“不变”)
②400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数17.4%.
③收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO):V(NO2)=1:1.
④在密闭容器内先通入一定量的CH4,然后再充入一定量的NO2.在不同温度下,同时发生反应Ⅱ:并在 t秒时测定其中NO2转化率,绘得图象如图所示:
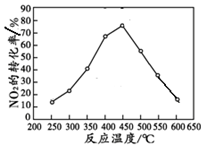
产生这一现象的原因是在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应正向进行.450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小.
(1)设反应 ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如表:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
结合表数据,根据反应①、②推导出推导出Q1、Q2、Q3的关系式Q3=Q1-Q2,反应③是吸热(填“放”或“吸”)热反应.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,其中两个反应为:
Ⅰ.CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)
Ⅱ.CH4(g)+2NO2(g) $\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)
实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应Ⅱ,测得在不同温度、不同投料比时,NO2的平衡转化率如表:
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
投料比,则K将增大.(填“增大”、“减小”或“不变”)
②400K时,将投料比为1的NO2和CH4的混合气体共0.04mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数17.4%.
③收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO):V(NO2)=1:1.
④在密闭容器内先通入一定量的CH4,然后再充入一定量的NO2.在不同温度下,同时发生反应Ⅱ:并在 t秒时测定其中NO2转化率,绘得图象如图所示:

产生这一现象的原因是在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应正向进行.450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小.
7.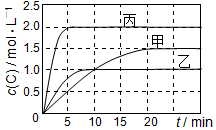 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大 | |
| B. | 达到平衡时反应吸收的热量:Q丙>2Q乙 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
4.恒容容器中,2SO2(g)+O2(g)?2SO3 (g)△H=-296.6kJ/mol,下列判断不正确的是( )
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |
11.生活处处有化学,下列说法正确的是( )
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
5.下列说法正确的是( )
| A. | 增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂虽然不参加化学反应,但能增大单位体积内活化分子的数目,从而增大反应速率 |
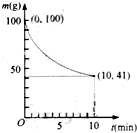 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: