题目内容
3. 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:①Ni(s)+4CO(g)$\stackrel{50℃}{?}$ Ni(CO)4(g)△H<0
②Ni(CO)4(g)$\stackrel{230℃}{?}$Ni(s)+4CO(g)△H>0
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有及时移走Ni(CO)4、加压.
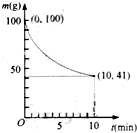
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示.Ni(CO)4在0~10min的平均反应速率为0.05mol•L-1min-1.
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时bc.
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆增大
(4)简述羰基法提纯粗镍的操作过程.先将粗镍和CO在50℃反应生成羰基镍,然后将羰基镍转移到另外一个中,升温至230℃热解得到纯镍
(5)储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料.如镧镍合金,它吸收氢气可结合成金属氢化物,其化学式可近似地表示为LaNi5H6 (LaNi5H6 中各元素化合价均可看作是零),它跟NiO(OH)可组成镍氢可充电电池:LaNi5H6+6NiO(OH)$?_{充电}^{放电}$LaNi5+6Ni(OH)2 该电池放电时,负极反应是LaNi5H6+6OH--6e-=LaNi5+6H2O. 市面上出售的标称容量为2 000mA h(mA h表示毫安时)的1节镍氢电池至少应含有镧镍合金5.4g(结果保留两位有效数字,已知1mol电子的电量为96500库仑或安培•秒 Mr(LaNi5)=434).
分析 (1)反应Ni(S)+4CO(g)?Ni(CO)4(g)+Q是放热反应,反应前后气体体积减小,依据平衡移动原理分析;
(2)粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g═59g;镍的质量=59g×98.5%=58.115g依据化学方程式计算Ni(CO)4的质量,计算物质的量得到变化浓度,根据化学反应速率概念计算得到;
(3)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小;
(4)利用信息可知,可采取在低温(50℃)时让粗镍和CO作用,使生成的Ni(CO)4在230℃时分解即可得到纯镍;
(5)根据反应的总方程式可知阴极应为LaNi5LaNi5H6被还原生成LaNi5H6;根据1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mAh的1节镍氢电池则要转移$\frac{2000×3600}{96500}$×10-3mol电子,再根据电极反应计算需要金属镍的质量.
解答 解:(1)反应①是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、从反应体系中移走Ni(CO)4(g)等措施均可使反应正向进行,提高Ni(CO)4的产率,
故答案为:及时移走Ni(CO)4,加压;
(2)随反应进行,粗镍减少的质量即为参加反应①消耗的镍的质量,粗镍的纯度98.5%,1-10min内粗镍质量减少100g-41g=59g;镍的质量=59g×98.5%=58.115g在0~10min,生成Ni的物质的量=$\frac{(100-41)×98.5%}{59}$=0.985mol,故在0~10min,v[Ni(CO)4]=$\frac{\frac{0.985mol}{2L}}{10min}$=0.985mol/(2L×10min)=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
(3)由反应①为放热反应可知反应②为吸热反应,因此反应②达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小;
a.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行,平衡常数减小;
b.温度降低平衡向放热反应方向进行,反应②是吸热反应,平衡逆向进行一氧化碳浓度减小;
c.依据反应分析,温度降低反应①平衡正向进行,反应②逆向进行,镍质量减小;
d.平衡逆向进行,温度降低,v逆[Ni(CO)4]减小;
故答案为:bc;
(4)利用信息可知,可采取在低温(50℃)时让粗镍和CO作用,使生成的Ni(CO)4在230℃时分解即可得到纯镍,在封闭的玻璃管一端放入粗镍,控制温度在50℃,通入CO气体,一点时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍,
故答案为:先将粗镍和CO在50℃反应生成羰基镍,然后将羰基镍转移到另外一个中,升温至230℃热解得到纯镍;
(5)放电时,负极失电子发生氧化反应,电极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O,因为1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mA•h的1节镍氢电池则要转移$\frac{2000×3600}{96500}$×10-3mol电子,又根据阴极反应LaNi5+6e-+6H2O═LaNi5H6+6OH-,所以1mol镧镍合金转移6mol电子,所以2000mAh的1节镍氢电池则要镧镍合金的质量为$\frac{2000×3600}{96500}$×10-3mol×$\frac{1}{6}$×(139+59×5+6)g/mol=5.4g,故答案为:LaNi5H6+6OH--6e-=LaNi5+6H2O;5.4.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确化学平衡及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 | |
| D. | 洗涤油污常用热的碳酸钠溶液 |

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍 |
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),△H增大 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
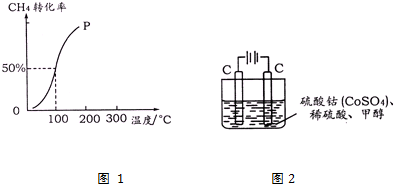

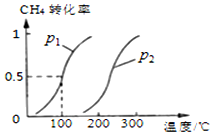 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.