题目内容
4.恒容容器中,2SO2(g)+O2(g)?2SO3 (g)△H=-296.6kJ/mol,下列判断不正确的是( )| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |
分析 A.为可逆反应,不能完全转化;
B.增大压强,正逆反应速率均增大;
C.物质的量越大,压强越大,平衡正向进行的趋势越大;
D.平衡后再加入1molSO3,压强增大.
解答 解:A.为可逆反应,不能完全转化,则2体积SO2和足量O2反应,一定不能生成2体积SO3,故A正确;
B.增大压强,正逆反应速率均增大,平衡正向移动,且正反应速率大于逆反应速率,故B正确;
C.物质的量越大,压强越大,平衡正向进行的趋势越大,则加入2molSO2和1molO2放出的热量大于加入1molSO2和0.5molO2放出热量的2倍,故C错误;
D.平衡后再加入1molSO3,压强增大,平衡正向移动,SO2的转化率增大,SO2的体积分数比原平衡减小,故D正确;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意可逆反应不能完全转化及选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
14.有一种烃,其结构简式可以表示为:
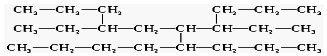
命名该有机物时,应认定它的主链上的碳原子数目是( )

命名该有机物时,应认定它的主链上的碳原子数目是( )
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
15.下列反应的离子方程式正确的是( )
| A. | 向明矾溶液中加入少量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加少量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 硫化钠溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
12.某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不改变,可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是ACE
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:第③步(填序号)
(4)根据下列数据:
请计算待测烧碱溶液的浓度为0.5000mol/L.
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为84.00%.(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/moL).
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不改变,可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是ACE
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:第③步(填序号)
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.45 |
| 第二次 | 20.00 | 4.00 | 29.05 |
| 第三次 | 20.00 | 3.00 | 30.00 |
| 第四次 | 20.00 | 2.00 | 27.00 |
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为84.00%.(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/moL).
16.下列说法正确的是( )
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 | |
| D. | 洗涤油污常用热的碳酸钠溶液 |
13.配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
| A. | 移液时,不慎将液体流到瓶外 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 定容时俯视刻度线和液面 |