题目内容
7.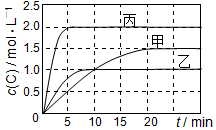 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大 | |
| B. | 达到平衡时反应吸收的热量:Q丙>2Q乙 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
分析 甲乙只有温度不同,根据先拐先平数值大知,温度乙>甲,升高温度C浓度减小,说明平衡逆向移动,则正反应是放热反应,△H<0;
由表中数据知,乙丙只有反应物浓度不同,丙中浓度大于甲,则反应速率丙>甲;
乙中平衡时A的转化率为$\frac{1mol/L×0.5L×\frac{1}{2}}{1.5mol}$=$\frac{1}{6}$,丙中A的转化率为$\frac{2mol/L×1L×\frac{1}{2}}{6mol}$=$\frac{1}{6}$,丙中压强为乙中2倍,压强增大平衡不移动,故x=1;
A.平衡后,向甲容器中再充入0.5 mol A,A的转化率减小、B的转化率均增大;
B.如果乙丙是等效平衡时,则丙容器是1L时加入的A、B物质的量应该分别是3mol、1mol,实际上是加入6molA、2molB,相当于增大压强,增大压强平衡不移动,两个容器中A的转化率相等,根据物质的量与反应热的关系计算;
C.该反应前后气体体积不变,则压强不影响平衡移动;
D.计算甲中平衡时各组分的浓度,进而计算平衡常数,令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,再表示出平衡时各组分的浓度,利用平衡常数列方程计算x的值,进而计算A的转化率.
解答 解:甲乙只有温度不同,根据先拐先平数值大知,温度乙>甲,升高温度C浓度减小,说明平衡逆向移动,则正反应是放热反应,△H<0;
由表中数据知,乙丙只有反应物浓度不同,丙中浓度大于甲,则反应速率丙>甲;
乙中平衡时A的转化率为$\frac{1mol/L×0.5L×\frac{1}{2}}{1.5mol}$=$\frac{1}{6}$,丙中A的转化率为$\frac{2mol/L×1L×\frac{1}{2}}{6mol}$=$\frac{1}{6}$,丙中压强为乙中2倍,压强增大平衡不移动,故x=1;
A.当反应物的物质的量之比等于其计量数之比时A的转化率最大,所以平衡后,向甲容器中再充入0.5 mol A,A的转化率减小、B的转化率均增大,故A错误;
B.如果乙丙是等效平衡时,则丙容器是1L时加入的A、B物质的量应该分别是3mol、1mol,实际上是加入6molA、2molB,相当于增大压强,增大压强平衡不移动,两个容器中A的转化率相等,则乙丙中反应掉的同一种物质的物质的量之比为1:2,则达到平衡时反应吸收的热量:Q丙=2Q乙,故B错误;
C.该反应前后气体体积不变,则压强不影响平衡移动,所以若平衡时保持温度不变,改变容器体积平衡不移动,故C正确;
D.甲中平衡时C的浓度为1.5mol/L,则:
A(g)+B(g)?2C(g)
开始(mol/L):3 1 0
变化(mol/L):0.75 0.75 1.5
平衡(mol/L):2.25 0.25 1.5
故T1℃,该反应的平衡常数为K=$\frac{1.{5}^{2}}{2.25×0.25}$=4
令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,则:
A(g)+B(g)?2C(g)
开始(mol/L):1 3 0
变化(mol/L):x x 2x
平衡(mol/L):1-x 3-x 2x
所以$\frac{(2x)^{2}}{(1-x).(3-x)}$=4,解得:x=0.75,故A的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,故D错误;
故选C.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析判断及计算能力,正确判断x值、反应热及正确建立等效平衡是解本题关键,注意:化学平衡常数只与温度有关,题目难度中等.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案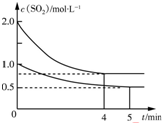 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 放出的热量Q:Q(甲)>2Q(乙) | |
| B. | 体系总压强p:p(甲)>2p(乙) | |
| C. | 乙中前5 min内的反应速率v(O2)=0.05mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)>v(逆) |
| A. | 向明矾溶液中加入少量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加少量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 硫化钠溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
| A. | 电离平衡常数可以表示弱电解质的相对强弱 | |
| B. | 电离平衡常数受溶液浓度的影响 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 |
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不改变,可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是ACE
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:第③步(填序号)
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.45 |
| 第二次 | 20.00 | 4.00 | 29.05 |
| 第三次 | 20.00 | 3.00 | 30.00 |
| 第四次 | 20.00 | 2.00 | 27.00 |
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为84.00%.(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/moL).
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 | |
| D. | 洗涤油污常用热的碳酸钠溶液 |