题目内容
15.一定条件下反应N2+3H2?2NH3达平衡,当单独改变下述条件后有关叙述一定错误的是( )| A. | 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 | |
| B. | 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 | |
| C. | 降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 | |
| D. | 增加c(N2),v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 |
分析 A.加入催化剂,正逆反应速率都改变,但为同等程度的改变;
B.增大压强,正逆反应速率都增大,平衡正向移动;
C.降低温度,正逆反应速率都减小,反应逆向移动;
D.增加反应物浓度,正反应速率增大,但逆反应速率不变.
解答 解:A.加入催化剂,正逆反应速率都改变,但为同等程度的改变,所以正逆反应速率仍然相等,所以平衡不移动,故A正确;
B.增大压强,正逆反应速率都增大,平衡正向移动,因为v(正)增加倍数大于v(逆)增加倍数,故B正确;
C.降低温度,正、逆反应速率都减小,正反应放热,平衡向放热反应方向进行,V正减小倍数小于V逆减小倍数,故C错误;
D.增大氮气的浓度瞬间,反应物浓度增大,生成物浓度不变,则正反应速率增大,逆反应速率不变,故D错误;
故选CD.
点评 本题考查化学平衡的影响因素,难度中等,明确外界条件对反应速率影响原理是解本题关键,D选项注意根据改变条件的瞬间浓度变化判断反应速率变化,为易错点.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
20.一定能在下列溶液中大量共存的离子组是( )
| A. | PH=12的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变红色的溶液:Na+、Al3+、NO3-、SO42- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42- |
7.将质量分数为20%的氨水与等体积的水混合,得到的混合溶液的质量分数为( )
| A. | 10% | B. | 大于10% | C. | 小于10% | D. | 无法确定 |
4.下列叙述中正确的是( )
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
5.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律.如:Na2O2+SO2→Na2SO4、Na2O2+SO3→Na2SO4+O2,据此,你认为下列方程式中不正确的是( )
| A. | 2Na2O2+2Mn2O7→4NaMnO4+O2↑ | B. | 2Na2O2+P2O3→Na4P2O7 | ||
| C. | 2Na2O2+2 N2O3→NaNO2+O2↑ | D. | 2 Na2O2+2 N2O5→4NaNO3+O2↑ |
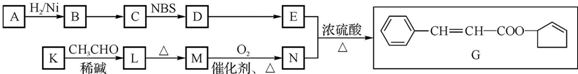
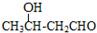
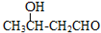 $\stackrel{△}{→}$CH3CH=CHCHO+H2O
$\stackrel{△}{→}$CH3CH=CHCHO+H2O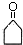 .
. .
.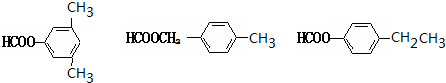 (其中两种).
(其中两种).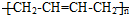 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{氢氧化钠醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
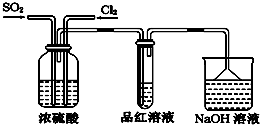
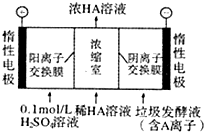 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.