题目内容
7.将质量分数为20%的氨水与等体积的水混合,得到的混合溶液的质量分数为( )| A. | 10% | B. | 大于10% | C. | 小于10% | D. | 无法确定 |
分析 本题可以看出,氨水浓度越大密度越小,等体积相混合时,浓度较稀的氨水质量较大,而较浓的氨水的质量较小,这样混合后,所得溶液浓度当然要比原来两个质量分数的平均值偏小些.
解答 解:水的质量分数为0,则混合后氨水的质量分数为$\frac{0+20%}{2}$=10%,等体积的两种氨水,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于10%.
故选C.
点评 本题考查溶液浓度的计算和大小比较,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度较大,注意氨水的浓度越大密度越小.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 常温下,pH=2的醋酸溶液中所含H+的数目为0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA | |
| D. | 精炼铜时,阴极质量增加6.4g,则电路中转移的电子数为0.2NA |
15.一定条件下反应N2+3H2?2NH3达平衡,当单独改变下述条件后有关叙述一定错误的是( )
| A. | 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 | |
| B. | 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 | |
| C. | 降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 | |
| D. | 增加c(N2),v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 |
2.关于下列各实验装置的叙述中,不正确的是( )


| A. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| B. | 装置②可用于收集H2、Cl2等气体 | |
| C. | 装置③可用于有关NH3实验的尾气处理 | |
| D. | 装置④可用于洗涤BaSO4淀表面吸附的少量氯化钠 |
12.下列离子方程式表达正确的是( )
| A. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性H++Ba2++OH-+SO42-═BaSO4↓+H2O | |
| B. | 酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 钢铁腐蚀时可能发生的正极反应为:4OH-+4e-═2H2O+O2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
19.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,所得溶液Q中的c(Fe3+):c(Fe2+)=2:3,下列有关说法中正确的是( )
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
16.现有一种铝和镁的混合物样品.某学生分别取0.9g此样品进行四次反应,并收集标准状况的氢气.有关数据记录如下表:
(1)请写出固体与NaOH溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)请计算固体中铝、镁的物质的量.
| 实验序号 | 固体质量 | 加入某浓度盐酸的体积/mL | 加入某浓度NaOH的体积/mL | 收集到气体体积/mL |
| 1 | 0.9 | 20.0 | ─ | 1008 |
| 2 | 0.9 | 30.0 | ─ | 1008 |
| 3 | 0.9 | ─ | 20.0 | 672 |
| 4 | 0.9 | ─ | 30.0 | 672 |
(2)请计算固体中铝、镁的物质的量.
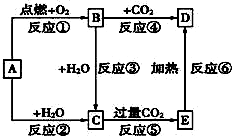 如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去).
如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.已知A在空气中燃烧生成淡黄色固体(部分产物已略去).