题目内容
3.某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置.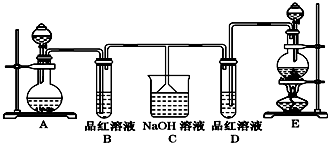
(1)连接好装置后,实验前必须进行的一步操作是检查装置的气密性.(回答操作名称,不必叙述操作细节)
(2)实验室用Na2SO3与硫酸反应制备SO2,MnO2跟浓盐酸共热反应制备Cl2时.制备Cl2应选用上图A、E两发生装置中E装置(填装置序号),通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的离子方程式为4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色.停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:恢复红色,D:无变化.
(4)实验小组利用下图所示装置探究两种气体按不同比例混合后的漂白性.
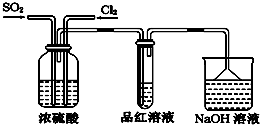
试分析:
①实验小组在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:SO2和Cl2按1:1混合时,发生反应:SO2+Cl2+2H2O═2HCl+H2SO4,使混合气体失去漂白作用.(结合反应方程式回答).
②盛NaOH溶液的烧杯吸收尾气一段时间后,经分析:D中溶液仍呈强碱性,且一定存在Cl-、OH-和SO42-.对于可能存在的其他阴离子,小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
现限选以下试剂,设计实验方案,进行实验,请完善实验步骤并填写预期现象.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于F、G两试管中.
步骤二:向F试管中滴加少量b (填序号),若溶液褪色(填现象),则假设1成立.
步骤三:向G试管中滴加少量d(填序号),若溶液变蓝色(填现象),则假设2成立.
分析 (1)连接好装置后必须进行检查装置气密性,确保装置气密性良好,避免实验失败且氯气、二氧化硫泄漏污染空气;
(2)根据反应物的状态和反应条件选择反应装置,用分液漏斗向烧瓶中加入适量的浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气;
(3)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(4)①氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性;
②步骤二:KMnO4 具有强氧化性,SO32-中+4价的硫具有还原性;
步骤三:淀粉遇到碘单质显蓝色.
解答 解:(1)该实验装置中连接了多个仪器,且氯气、二氧化硫有毒气体,不避免氯气、二氧化硫泄漏,会污染空气且浪费试剂,所以在实验前需要检验装置气密性,
故答案为:检查装置的气密性;
(2)实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;
用分液漏斗向烧瓶中加入适量的浓盐酸,加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn 2++Cl2↑+2H2O,
故答案为:E;分液漏斗;4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:恢复红色;无变化;
(4)①氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应SO2+Cl2+2H2O═2HCl+H2SO4,而使气体失去漂白性,
故答案为:SO2和Cl2按1:1混合时,发生反应:SO2+Cl2+2H2O═2HCl+H2SO4,使混合气体失去漂白作用;
②步骤二:KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,KMnO4褪色,
故答案为:b;褪色;
步骤三:ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色,
故答案为:d;变蓝色.
点评 本题考查了氯气的性质和次氯酸和二氧化硫的漂白性,解题关键在于理解制取的原理以及灵活运用氯气的性质等相关知识解答问题,题目综合性强,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的,其漂白原理也不同,二氧化硫不能使酸碱指示剂褪色,为易错点,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 1molH2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 1mol任何气体体积均为22.4L | D. | 0.5molSO2分子的质量为32g |
| A. | t℃时,HA的Ka=10-2b/1000a/MV | |
| B. | 物质的量浓度:c(HA)=1000a/MV mol•L-1 | |
| C. | t℃时,HA的溶解度:S=100a/ρV g | |
| D. | HA的质量分数:ω(HA)=(a/ρV)×100% |
| A. | 铁与稀硫酸反应Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 常温下,pH=2的醋酸溶液中所含H+的数目为0.01NA | |
| C. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA | |
| D. | 精炼铜时,阴极质量增加6.4g,则电路中转移的电子数为0.2NA |
| A. | 液态溴化氢 | B. | 蔗糖 | C. | 铝 | D. | 硝酸溶液 |
| A. | 加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 | |
| B. | 加压,v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 | |
| C. | 降温,v(正)和v(逆)都减少,且v(正)减少倍数大于v(逆)减少倍数 | |
| D. | 增加c(N2),v(正)和v(逆)都增大,且v(正)增加倍数大于v(逆)增加倍数 |
| A. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性H++Ba2++OH-+SO42-═BaSO4↓+H2O | |
| B. | 酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 钢铁腐蚀时可能发生的正极反应为:4OH-+4e-═2H2O+O2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 标准状况下气体的体积(mL) | 280 | 336 | 336 |
| A. | 甲、乙组的实验中,盐酸均是过量的 | B. | 盐酸的物质的量浓度为0.8mol L-1 | ||
| C. | 合金中镁、铝的物质的量之比为1:1 | D. | 丙组中铝的物质的量为0.0045mol |