题目内容
4.(1)已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为120g•mol-1(2)0.3mol氨气和0.4mol二氧化碳的质量不相等(填“相等”或“不相等”,下同),所含原子数相等.
(3)4g H2与22.4L(标准状况)CO2相比,所含分子数目较多的是H2.
(4)3.01×1023个CO2分子中含1 mol氧原子,在标准状况下其体积为11.2L,它与18g H2O含有相同的氧原子数.
(5)写出下列物质的电离方程式:硫酸铵(NH4)2SO4=2NH4++SO42-;氢氧化钡Ba(OH)2=Ba2++2OH-.
分析 (1)由质量守恒可知,C的质量为16g+20g-30g=6g,结合M=$\frac{m}{n}$计算;
(2)结合m=nM计算及分子构成计算;
(3)结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$计算;
(4)结合n=$\frac{N}{{N}_{A}}$、V=nVm、m=nM计算;
(5)硫酸铵、氢氧化钡均为强电解质,完全电离,遵循电荷、原子守恒.
解答 解:(1)由质量守恒可知,C的质量为16g+20g-30g=6g,C的摩尔质量为$\frac{6g}{0.05mol}$=120g•mol-1,故答案为:120g•mol-1;
(2)由0.3mol×17g/mol≠0.4mol×44g/mol,原子的物质的量为0.3mol×4=0.4mol×3,可知二者质量不相等,原子数相等,故答案为:不相等;相等;
(3)二者的物质的量分别为$\frac{4g}{2g/mol}$=2mol、$\frac{22.4L}{22.4L/mol}$=1mol,则所含分子数目较多的是H2,故答案为:H2;
(4)3.01×1023个CO2分子中含$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$×2=1mol氧原子,在标准状况下其体积为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$×22.4L/mol=11.2L,它与1mol×18g/mol=18g H2O含有相同的氧原子数,
故答案为:1;11.2; 18;
(5)电离方程式分别为(NH4)2SO4=2NH4++SO42-、Ba(OH)2=Ba2++2OH-,故答案为:(NH4)2SO4=2NH4++SO42-;Ba(OH)2=Ba2++2OH-.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成及基本计算公式的应用,题目难度不大.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案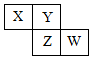 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
| A. |  | B. | HBr | C. |  | D. | HCHHCOO- |
| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |