题目内容
16.表各组变化中,后者一定包括前者的是( )| A | 化学变化 | 物理变化 |
| B | 氧化还原反应 | 分解反应 |
| C | 氧化还原反应 | 化合反应 |
| D | 中和反应 | 复分解反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据物质变化的分类,若物质的成分没有发生变化,只是形态发生变化的为物理变化,有新化学物质生成的为化学变化,两者是并列的关系;氧化还原反应一定有电子的得失,复分解反应只是反应物相互交换成分,不存在电子的得失;有单质参加的化合反应一定有电子的得失,属于氧化还原反应,而氧化还原反应则包含更多的类型;中和反应属于复分解反应等知识点来解题.
解答 解:A.化学变化和物理变化是物质变化的两种基本形式,是并列的关系,故A错误;
B.氧化还原反应要有电子的得失,而复分解反应只是参与反应的物质相互交换成分,因此不存在包含关系,故B错误;
C.化合反应不一定是氧化还原反应,但有单质参加的化合反应属于氧化反应,而氧化还原反应不一定是化合反应,故C错误;
D.中和反应属于复分解反应,故D正确;
故选D.
点评 本题考查了物理变化和化学变化不同,氧化还原反应与复分解反应和化合反应的关系,中和反应与复分解反应的关系等知识点,题目难度不大.

练习册系列答案
相关题目
7.下列各组混合物可用分液漏斗分离的一组是( )
| A. | 汽油和水 | B. | 碘和四氯化碳 | C. | 淀粉溶液和泥沙 | D. | 水和酒精 |
11.下列措施不能使3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)反应速率改变的是( )
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
①增加铁的用量
②恒压下增加水的用量
③用铁粉代替铁屑
④升温
⑤压强不变,充入N2使容器体积增大.
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
1.下列离子方程式改写成化学方程式正确的是( )
| A. | Mg2++2OH-═Mg(OH)2↓ Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2 | |
| B. | Fe+Cu2+═Fe2++Cu Fe+CuO═FeO+Cu | |
| C. | Ag++Cl-═AgCl↓ Ag2SO4+2HCl═2AgCl↓+H2SO4 | |
| D. | CO2+2OH-═CO32-+H2O CO2+2NH3•H2O═(NH4)2CO3+H2O |
8.氧气的摩尔质量是( )
| A. | 32g | B. | 16g | C. | 32g/mol | D. | 16g/mol |
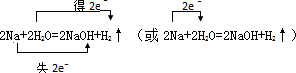 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.
 氮元素及其化合物在生产、生活中有着广泛的应用.
氮元素及其化合物在生产、生活中有着广泛的应用.