题目内容
15.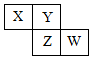 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
分析 X、Y、Z、W均为短周期元素,若Z原子的最外层电子数是第一层电子数的3倍,Z为第三周期元素,则Z的最外层电子数为6,Z为S,结合位置可知,Y为O,X为N,W为Cl,然后结合元素周期律来解答.
解答 解:A.非金属性Y>Z,则Y单质与氢气反应较Z剧烈,故A正确;
B.非金属性W>Z,则最高价氧化物对应水化物酸性W比Z强,故B错误;
C.非金属性Y>X,则X单质氧化性弱于Y单质,故C错误;
D.X与W的原子核外电子数相差17-7=10,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.在固定容积的容器中,某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度( mol/L )随反应时间( min )的变化情况见表.
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).
20.下列说法中不正确的是( )
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
7.下列各组混合物可用分液漏斗分离的一组是( )
| A. | 汽油和水 | B. | 碘和四氯化碳 | C. | 淀粉溶液和泥沙 | D. | 水和酒精 |
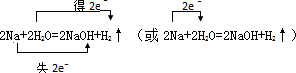 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.