题目内容
16.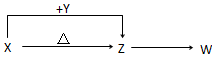 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去).
请回答:
(1)W的电子式是
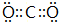 .
.(2)X与Y在溶液中反应的离子方程式是HCO3-+OH-=CO32-+H2O.
(3)将4.48L(标准状况)W通入100mL3mol/L的Y的水溶液后,离子方程式为2CO2+3OH-═CO32-+HCO3-+H2O.
(4)自然界中存在X、Z和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为2.65g.
(5)向过量的Z溶液中通入Cl2可以制得漂白液,该反应的离子方程式:2CO32-+Cl2+H2O═Cl-+2 HCO3-+ClO-.
分析 X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,可推知,X为NaHCO3,Y为NaOH,Z为Na2CO3,Z得到W为无色无味的气体,应是与酸反应生成的CO2.
(1)二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水;
(3)将4.48L(标准状况)二氧化碳是0.2mol,通入100mL3mol/L的NaOH的水溶液后,氢氧化钠的物质的量为:0.3mol,因为1<$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$<2,所以产物中既有碳酸钠也有碳酸氢钠;
(4)取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为 $\frac{1}{2}$×0.1L×0.5mol/L×106g/mol=2.65g;
(5)向过量的碳酸钠溶液中通入Cl2可以制得漂白液,根据酸性:盐酸>碳酸>次氯酸>碳酸氢钠,由此分析解答.
解答 解:X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,可推知,X为NaHCO3,Y为NaOH,Z为Na2CO3,Z得到W为无色无味的气体,应是与酸反应生成的CO2,
(1)W为CO2,电子式为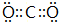 ,故答案为:
,故答案为: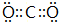 ;
;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(3)将4.48L(标准状况)二氧化碳是0.2mol,通入100mL3mol/L的NaOH的水溶液后,氢氧化钠的物质的量为:0.3mol,因为1<$\frac{n(NaOH)}{n(C{O}_{2})}$=$\frac{3}{2}$<2,所以产物中既有碳酸钠也有碳酸氢钠,设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,则$\left\{\begin{array}{l}{2x+y=0.3}\\{x+y=0.2}\end{array}\right.$,所以$\left\{\begin{array}{l}{x=0.1mol}\\{y=0.1mol}\end{array}\right.$,所以离子反应方程式为:2CO2+3OH-═CO32-+HCO3-+H2O,故答案为:2CO2+3OH-═CO32-+HCO3-+H2O;
(4)取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为 $\frac{1}{2}$×0.1L×0.5mol/L×106g/mol=2.65g,
故答案为:2.65;
(5)向过量的碳酸钠溶液中通入Cl2可以制得漂白液,根据酸性:盐酸>碳酸>次氯酸>碳酸氢钠,所以向过量的碳酸钠溶液中通入Cl2可以制得漂白液,反应的离子方程式为:2CO32-+Cl2+H2O═Cl-+2 HCO3-+ClO-,故答案为:2CO32-+Cl2+H2O═Cl-+2 HCO3-+ClO-.
点评 本题考查无机物的推断,涉及钠元素化合物的转化,焰色反应是推断突破口,注意掌握碳酸钠、碳酸氢钠等物质的性质,把难度不大.

 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
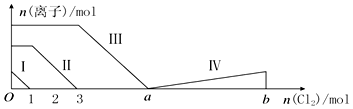
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
| A. | 对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2,则平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
| A. | 增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 使用正催化剂,活化分子百分数增大,化学反应速率增大 | |
| D. | 加入反应物,活化分子百分数增大,化学反应速率增大 |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.