题目内容
7. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是BD.
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次 并在操作步骤空白处填上适当仪器名称)BCAFED.
A.用30mL水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”,填B表示“偏小”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面B
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水B.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)根据各量的计算公式是否与体积有关判断;
(3)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀装瓶贴标签,据此排序;
A.烧杯内壁和玻璃棒上沾有溶质,为保证实验成功,应进行洗涤;
E.定容时,加蒸馏水到离刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)98%的浓硫酸(其密度为1.84g/cm3)物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9;
(2)A、n=c•V,所以溶液中HCl的物质的量与溶液体积有关,故A错误;
B、溶液的浓度是均一稳定的,与所取溶液的体积无关,故B正确;
C、N=n•NA=c•V•NA,所以与溶液体积有关,故C错误;
D、溶液的密度是均一的,所以与所取溶液的体积无关,故D正确;
故选:BD;
(3)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀装瓶贴标签,所以正确的步骤为:BCAFED;
A.烧杯和玻璃棒上沾有溶质,为保证实验成功,应进行洗涤;
E..定容时,加蒸馏水到离刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:BCAFED;烧杯内壁和玻璃棒;胶头滴管;
(4)a.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏低,故选B;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏低,故选B.
点评 本题考查了物质的量浓度的有关计算及配制一定物质的量浓度的溶液误差分析,难度不大,要注意配制一定物质的量浓度溶液的误差分析,根据验操作对c=$\frac{n}{V}$产生的影响判断,分析变化的物理量,从而确定浓度的变化.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 蛋白质都能与浓硝酸发生显色反应 | |
| B. | 糖类不都能发生水解反应 | |
| C. | 油脂都不能使溴的四氯化碳溶液退色 | |
| D. | 水是营养物质 |
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、胆矾 | ||
| C. | HNO3、乙醇、氯化钠 | D. | H3PO4、熟石灰、苛性钾 |
(1)配制250ml0.1mol/L的盐酸溶液
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
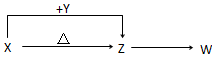 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.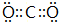 .
.