题目内容
5.二写出下列反应的化学方程式,是离子反应的并写出离子方程式:(1)碳酸钠溶液和澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、CO32-+Ca2+=CaCO3↓
(2)氢氧化镁与硫酸反应Mg(OH)2+H2SO4=MgSO4+2H2O、Mg(OH)2+2H+=Mg2++2H2O
(3)少量二氧化碳通入澄清石灰水CO2+Ca(OH)2=CaCO3↓+H2O、CO2+Ca2++2OH-=CaCO3↓+H2O.
分析 (1)碳酸钠溶液和澄清石灰水反应生成碳酸钙和氢氧化钠;
(2)氢氧化镁与硫酸反应生成硫酸镁和氢氧化钠;
(3)少量二氧化碳通入澄清石灰水反应生成碳酸钙和水.
解答 解:(1)碳酸钠溶液和澄清石灰水反应生成碳酸钙和氢氧化钠,化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;离子方程式:CO32-+Ca2+=CaCO3↓;
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、CO32-+Ca2+=CaCO3↓
(2)氢氧化镁与硫酸反应生成硫酸镁和氢氧化钠,化学方程式:Mg(OH)2+H2SO4=MgSO4+2H2O;离子方程式:Mg(OH)2+2H+=Mg2++2H2O;
故答案为:Mg(OH)2+H2SO4=MgSO4+2H2O、Mg(OH)2+2H+=Mg2++2H2O;
(3)少量二氧化碳通入澄清石灰水反应生成碳酸钙和水,化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
15.将下列物质按酸、碱、盐分类排列正确的是( )
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、胆矾 | ||
| C. | HNO3、乙醇、氯化钠 | D. | H3PO4、熟石灰、苛性钾 |
13.下列说法中正确的是( )
| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
20. 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
则反应N2(g)+3F2(g)═2NF3(g)的△H=-291.9KJ•mol-1
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
10.只改变一个条件,则下列对图象的解读正确的是( )
| A. | 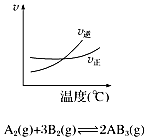 如图说明此反应的正反应是吸热反应 | |
| B. | 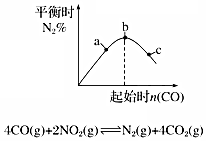 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
14.一定温度下,向aL的密闭容器中加入2molNO2(g),发生如下反应:2NO2?2NO+O2,此反应达到平衡的标志是( )
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
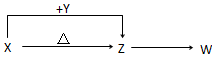 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.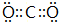 .
.