题目内容
4.归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )①向0.1mol•L-1 CH3COOH溶液中加入少量冰醋酸,平衡向正反应方向移动,电离程度增大;②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同;④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw.
| A. | ①②④ | B. | ②④ | C. | ②③ | D. | ①②③④ |
分析 ①CH3COOH浓度越大,电离程度越小;
②常温下,pH=3的醋酸溶液醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液浓度为0.001mol/L,混合后醋酸过量,根据电荷守恒分析;
③常温下,溶液中氯离子浓度越大,AgCl的溶解度越小;
④根据Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$、Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$计算出Ka•Kh即可.
解答 解:①向0.1mol•L-1 CH3COOH溶液中加入少量冰醋酸,平衡向正反应方向移动,CH3COOH浓度越大,电离程度越小,所以醋酸电离程度减小,故错误;
②常温下,pH=3的醋酸溶液醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液浓度为0.001mol/L,混合后醋酸过量,则溶液为醋酸和醋酸钠的混合物,溶液显酸性,溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故正确;
③常温下,溶液中氯离子浓度越大,AgCl的溶解度越小,同物质的量浓度的CaCl2和NaCl溶液中,CaCl2溶液的氯离子浓度大,所以CaCl2溶液中AgCl的溶解度小,故错误;
④已知Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$、Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,则Ka•Kh=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=c(OH-)×c(H+)=Kw,故正确;
故选B.
点评 本题考查电荷守恒、化学平衡、沉淀溶解平衡、弱电解质的电离和盐类的水解,题目难度中等,试题涉及的题量较大,知识点较广,充分考查了学生对所学知识的掌握情况,培养了学生灵活应用所学知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、胆矾 | ||
| C. | HNO3、乙醇、氯化钠 | D. | H3PO4、熟石灰、苛性钾 |
| A. |  | B. |  | C. |  | D. |  |
| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
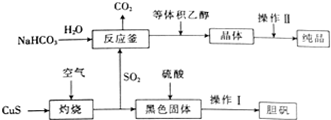 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用. X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体. .
.