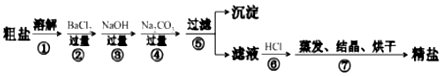
题目内容
11.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )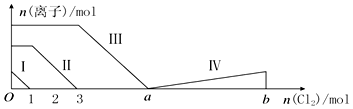
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
分析 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,还原性I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,又发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据溴离子判断溶液中n(FeBr2),根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值;
线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该含氧酸中含有I元素,根据电子守恒计算出含氧酸中I的化合价,然后写出其化学式,根据碘原子守恒判断增加多少.
解答 解:A.根据分析可知,线段Ⅱ为亚铁离子被氯气氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,不是氧化溴离子,故A错误;
B.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,a-b段I2被Cl2氧化,已知碘单质的物质的量为1mol,反应消耗氯气的物质的量为b-a=5mol,根据电子守恒,则该含氧酸中碘元素的化合价为:$\frac{(1-0)×2×5mol}{2mol}$=+5价,则该含氧酸为HIO3,即:线段Ⅳ表示IO3-的变化情况,IO3-增加了2moL,故B错误;
C.由分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故C正确;
D.n(FeI2):n(FeBr2)=n(I-):n(Br-)=2mol:6mol=1:3,故D错误;
故选C.
点评 本题考查氧化还原反应计算、氧化还原反应先后顺序、氧化性和还原性强弱比较等知识,试题综合性较强,难度较大,明确反应过程及反应原理为解题关键,试题培养了学生的分析能力及逻辑推理能力.

(1)配制250ml0.1mol/L的盐酸溶液
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.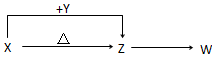 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体. .
.